REMDESIVIR: finalmente anche in una formulazione da inalare
REMDESIVIR: finalmente anche in una formulazione da inalare
Come ho scritto più volte, la somministrazione per infusione del remdesivir lo rende molto poco adatto a trattare precocemente l'infezione da SARS-CoV-2, specie in pazienti non ospedalizzati.
D'altra parte, l'efficacia piuttosto modesta di questo antivirale richiede che sia somministrato nelle fasi iniziali dell'infezione, se si vuole sperare che serva a qualcosa.
Fin da marzo-aprile, Gilead aveva negato di avere in preparazione una formulazione orale del farmaco e lasciato invece trapelare la possibilità di una preparazione da inalare.
Vivtex Corporation, invece, una società biotecnologica fondata da uno scienziato dell'MIT e che si occupa di produrre formulazioni orali di farmaci biologici, aveva
annunciato a fine aprile di essere intenzionata a provare a sviluppare una versione orale del remdesivir.
Ma che una simile, più comoda, formulazione sia possibile, Gilead lo esclude nel
documento che ha presentato all'EMA a inizio aprile per ottenere l'indicazione all'uso compassionevole del suo antivirale nei malati di COVID-19 in Europa.
Le ragioni per cui un farmaco può non essere adatto all'assunzione per bocca sono sostanzialmente due: 1. perché non viene assorbito dall'intestino, ma viene direttamente escreto attraverso le feci; oppure 2. perché viene assorbito dall'intestino e arriva al fegato, ma dal fegato viene fatto a pezzi che perdono ogni proprietà terapeutica e mandato ai reni, per essere espulso attraverso le urine.
Il caso del remdesivir è il secondo:
Remdesivir is not suitable for oral delivery as its poor hepatic stability would likely result in almost complete first-pass clearance.
Ma dal momento che era chiaro a tutti che un antivirale che dovrebbe essere dato subito, agli esordi dell'infezione, diventa molto meno utile se si aspetta che il malato sia così grave da finire in ospedale, Gilead aveva
annunciato di avere in studio qualche formulazione più adatta:
Our researchers are also looking at the future potential for developing inhaled and potentially oral dosage forms of remdesivir to help alleviate the need for hospital administration of the drug.
Daniel O’Day, CEO di Gilead, ha una predilezione per le lettere aperte. Ne ha scritta una
due giorni fa per comunicare al mondo che Gilead ha ricevuto dall'FDA il permesso di procedere ed è dunque pronta a iniziare delle sperimentazioni cliniche con la versione da inalare del remdesivir: questa settimana parte un trial su volontari sani, ad agosto inizierà un trial su persone malate di COVID-19.
La somministrazione da inalare spiana la via a maggiori successi? Gli steroidi in polvere, ad esempio, hanno rivoluzionato il trattamento dell'asma. Può succedere la stessa cosa nel caso di una malattia infettiva?
C'è ovviamente solo da augurarselo, anche se non è detto che mandare direttamente un farmaco nei polmoni risolva tutti i problemi di una infezione sistemica, con un virus che attacca prevalentemente cellule localizzate nelle vie respiratorie, ma non soltanto quelle. Inoltre, gli antibiotici che si assumono per via inalatoria sono usati in genere per infezioni polmonari croniche, come la fibrosi cistica, qui invece il remdesivir deve trattare un'infezione virale acuta e non è scontato che sarà sicuro ed efficace.
In ogni caso, le sperimentazioni di quest'estate qualche risposta la dovranno dare.
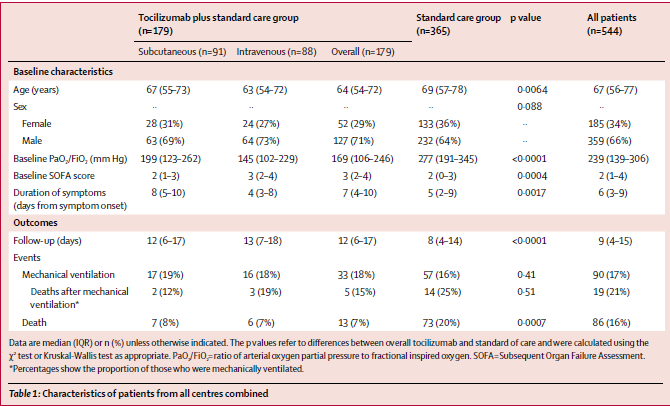
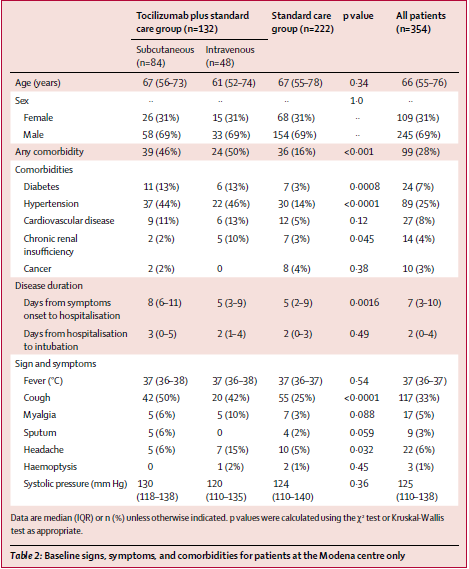
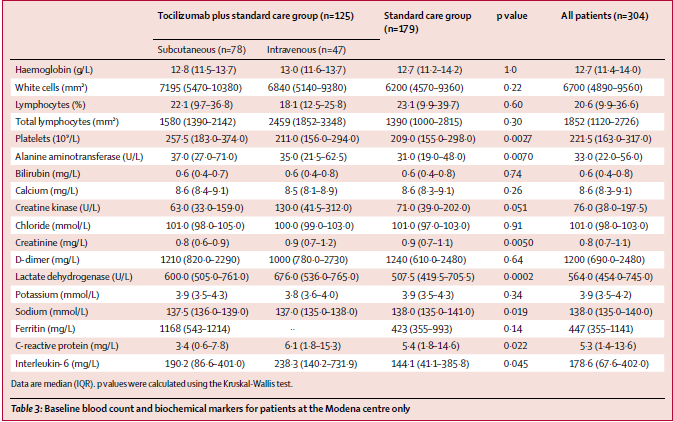
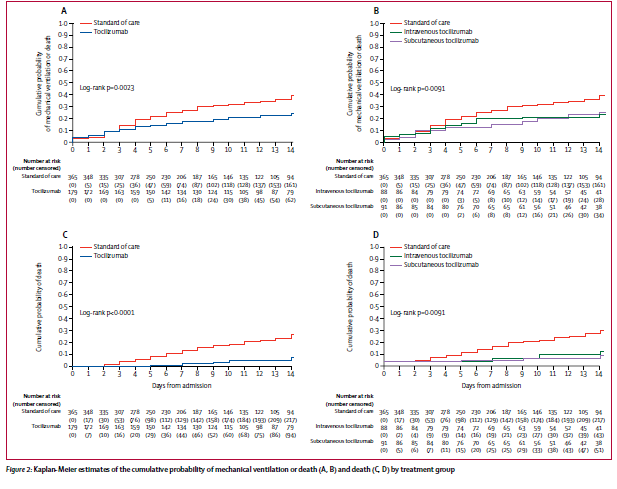
Visti anche i risultati non proprio esaltanti sui malati gravi, il farmaco nella sua versione da iniettare sarà testato su persone con infezione meno grave da SARS-CoV-2 e sarà testato in combinazione con altri farmaci che hanno il compito di intervenire sul danno infiammatorio causato dal virus.
Anzi, è già in sperimentazione insieme a farmaci immunomodulanti:
baricitinib, un JAK inibitore, e
tocilizumab, inibitore dell'IL-6. In entrambi i casi, la combinazione viene messa a confronto con remdesivir più placebo.