[CROI 2016] H. Günthard: Ostacoli e strategie di cura
Inviato: martedì 23 febbraio 2016, 9:36
Huldrych Günthard - The HIV Latent Reservoir: Obstacles and Strategies to a Cure
Il 12° Workshop per nuovi ricercatori, come gli 11 precedenti, ha lo scopo di sintetizzare lo stato dell’arte di alcune aree della ricerca di base e della ricerca clinica su HIV, presentando alcuni dei temi principali che saranno discussi durante il congresso.
Huldrych Günthard, dell’University Hospital di Zurigo, ha tenuto una lezione sul reservoir latente di HIV, sugli ostacoli che questo presenta al raggiungimento di una cura e sulle strategie che si stanno disegnando per superare questi ostacoli.
Per i frequentatori abituali di questa sezione del forum sui congressi e di Verso una Cura, solo un ripasso. Per chi si affaccia adesso a queste ricerche, spero sia un utile punto di partenza.
Günthard esordisce ricordando come il reservoir di HIV sia un enigma, perché è vero che la questione sembra semplice – il provirus di HIV si integra nella cellula ospite e le cellule latentemente infette se ne stanno lì per molto, molto tempo, obbligando ad assumere antiretrovirali a vita. Ed è vero che l’obiettivo sembra obbligato: per curare l’infezione da HIV si deve eliminare il reservoir latente. Ma la sfida è ancora aperta: quanto è grande il reservoir? Come facciamo ad arrivarci? Come facciamo a distruggerlo?
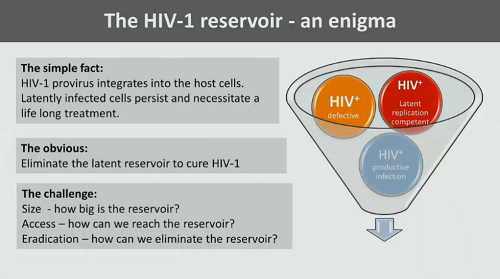
È da almeno il 1996 che sappiamo che virtualmente in ogni persona in terapia antiretrovirale è possibile rilevare cellule infette che contengono il DNA del virus (cioè il provirus).
Nel 1997,poi, sono state individuate cellule che non soltanto contengono HIV DNA “latente”, ma HIV DNA capace di replicarsi. Questo diede la conferma che un reservoir di HIV persiste durante la terapia.
Fra gli ostacoli alla cura sono da elencare:
1. La completa localizzazione del reservoir di HIV, che può essere localizzato in cellule – quindi bisogna capire esattamente in quali cellule e quale contributo queste diano all’estensione complessiva del reservoir:
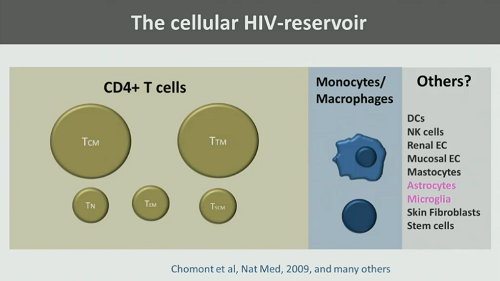
ma anche in comparti anatomici – sistema nervoso centrale, linfonodi e tessuti linfatici, altri organi:
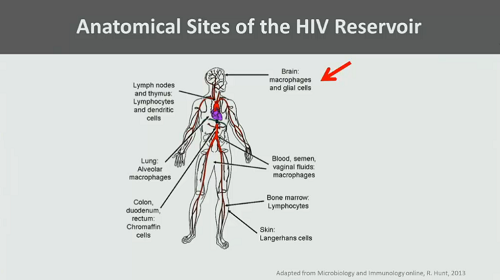
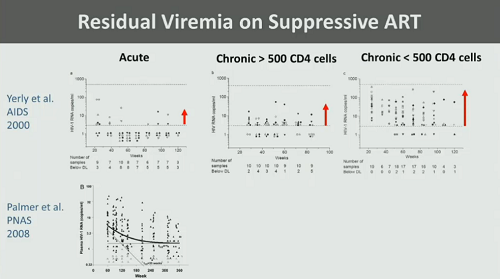
2. La difficoltà per la ART di avere accesso al reservoir latente: esistono test molto sensibili, che riescono a rilevare HIV RNA nel plasma anche dopo diversi anni di soppressione della viremia grazie alla terapia combinata.
Già dall’inizio degli anni 2000 sappiamo che se si comincia la ART durante la fase acuta dell’infezione si ha una viremia residua di molto inferiore che se si comincia durante la fase cronica e soprattutto se la si comincia quando ormai si è raggiunto uno stato di immunosoppressione. Ma tutti i trattamenti antiretrovirali lasciano comunque del virus residuo.
C’è un certo decadimento della viremia residua nei primi anni di ART, ma poi questo sostanzialmente si ferma e il livello di RNA virale rilevabile nel sangue, per quanto bassissimo, rimane costante.
Ma anche l’RNA virale associato alle cellule (cioè non circolante libero nel plasma) persiste durante la ART ed è rilevabile nelle cellule mononucleate del sangue periferico (PBMC), nei linfonodi e nella mucosa intestinale anche dopo anni di terapia.
3. La caratterizzazione dettagliata del reservoir di HIV: abbiamo cellule che davvero sono latentemente infette, che contengono dell’HIV DNA e minime, se non nulle, quantità di RNA trascritto; poi abbiamo cellule parzialmente attivate ma senza produzione di virus, che contengono HIV DNA e bassissimi livelli di RNA virale trascritto (in sostanza solo proteine come Tat, Rev e Nef); e infine abbiamo cellule in cui l’infezione è produttiva e che contengono sì provirus, ma anche alti livelli di RNA trascritto, e dunque producono effettivamente virioni e possono essere inibite dalla terapia antiretrovirale. Il gruppo di mezzo è quello più difficile da descrivere.
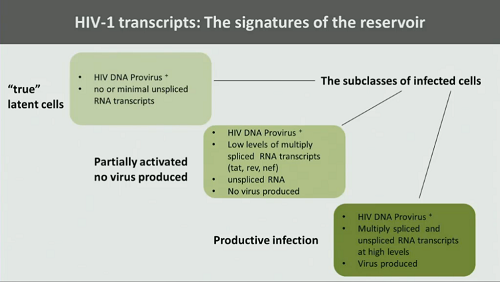
Nella slide che segue Günthard mostra un esempio di classificazione delle cellule infette in base al tipo di infezione (se con HIV DNA o RNA, e se HIV RNA a quali livelli di trascrizione), in base al tempo necessario a distruggere queste cellule quando si comincia la ART e poi negli anni successivi (nella tabella si va dalle più difficili da distruggere alle più facili). Quello che Günthard tiene a sottolineare è che la presenza di HIV RNA in una cellula non comporta necessariamente replicazione del virus:
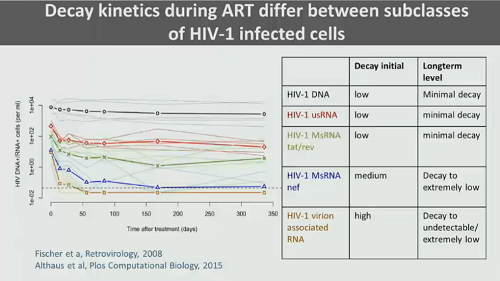
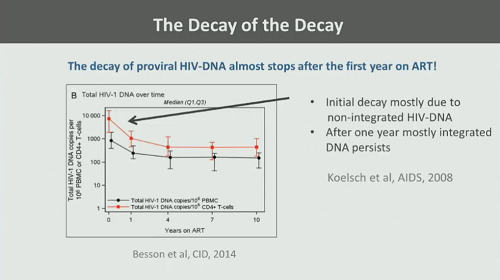
Come ha anticipato all’inizio della lezione, il decadimento del DNA provirale è estremamente lento e quasi si ferma dopo il primo anno di terapia: all’inizio il provirus non integrato sparisce in fretta e quel che poi rimane e persiste nel tempo è soprattutto DNA integrato nel genoma della cellula.
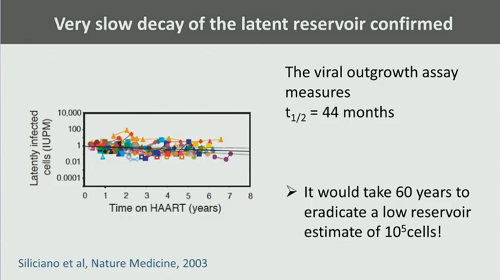
Siliciano ha stimato che il tempo necessario ad eradicare un reservoir di 100.000 cellule sia di 60 anni:
4. Perché tutto questo? Perché il decadimento del reservoir si ferma dopo circa un anno di terapia?
Le ragioni possono essere sostanzialmente due (e non alternative):

Günthard elenca dunque le ragioni a favore e contro la replicazione di basso livello, ricordando come tutte siano sostenute da mote ricerche (tonnellate di ricerche – dice Günthard).
PRO:
CONTRO:
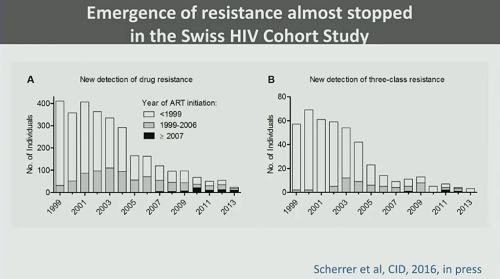
Quest’ultimo punto sarà discusso al CROI in uno studio sulla coorte svizzera (quindi 10.000 pazienti in terapia nel mondo reale), da cui si è osservato che, nel corso dell’ultimo decennio, l’emergenza di resistenze si è quasi fermata.
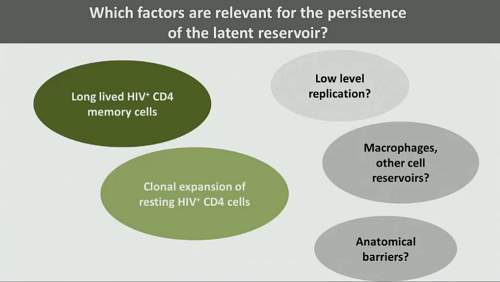
5. Quali sono i fattori determinanti per la persistenza del reservoir latente? Mentre di alcuni siamo sicuri, per confermare altri serve più ricerca:
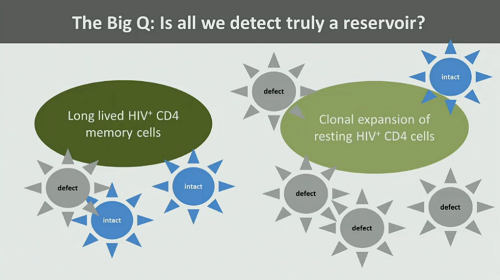
6. Quello che rileviamo è davvero un reservoir? Molto del virus contenuto in cellule latentemente infette è difettivo, quindi non riesce a replicarsi.
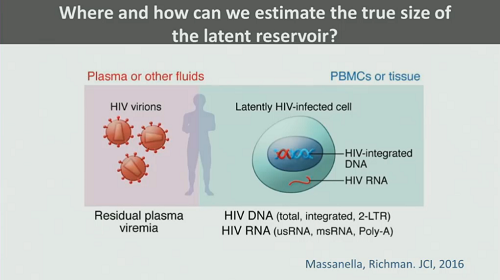
7. Come si fa a misurare il reservoir? Dobbiamo andare a stimarlo nel plasma o in altri liquidi biologici, dove troviamo sostanzialmente la viremia residua? Oppure si annida soprattutto nelle PBMC? E che cosa possiamo dire dei tessuti?
E con quali tipi di test è meglio misurarlo? Sappiamo che sia i metodi basati sulla PCR, sia i viral ourgrowth assay (VOA) hanno dei limiti e dei problemi.
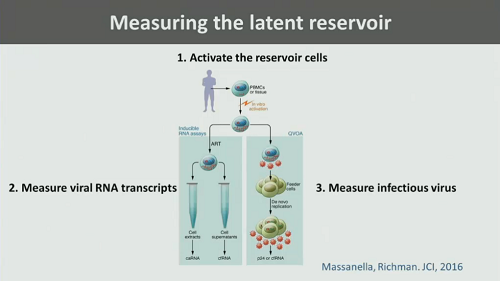
Poi Günthard ricorda un lavoro del Siliciano Lab di caratterizzazione e di distinzione del provirus in inducibile e non inducibile (cioè capace o meno di trascriversi) di cui abbiamo parlato tante volte. E ricorda come il VOA sovrastimi il virus capace di replicazione, mentre la PCR non sia in grado di distinguere fra provirus inducibile e provirus difettivo.
Le sfide tecniche sono molte e diverse:
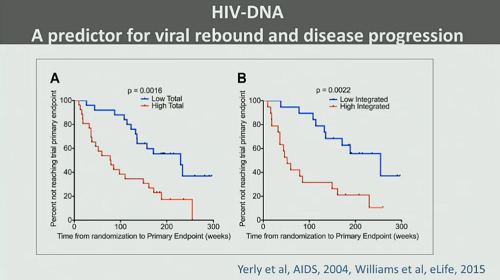
Per stimare il reservoir e predire il tempo di rebound della viremia quando si sostiene la ART si può usare il DNA virale, che viene utilizzato anche per valutare la progressione della malattia. Non è esente da limitazioni, ma in mancanza di meglio continua ad essere usato, soprattutto se si ha a che fare con grandi numeri di pazienti.
Di fatto, tutti i test ad oggi disponibili danno soltanto una stima surrogata del reservoir latente e l’unico modo per sapere se un intervento di cura ha avuto successo è interrompere la ART e stare a vedere che cosa succede, con tutti i rischi connessi a un rebound improvviso della viremia.
Dopo avere descritto gli ostacoli, Günthard dedica l’ultima parte della sua lezione alle strategie di cura e ricorda il primo tentativo – che definisce “eroico” – di svuotare il reservoir di persone in terapia usando insieme anticorpi anti-CD3 e l’IL-2. Era il 1999 il tentativo pionieristico si risolse in un disastro: il reservoir se ne rimase com’era, in compenso i pazienti ebbero effetti collaterali tremendi.
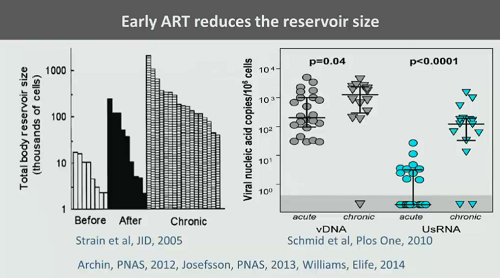
Quello che oggi sappiamo che funziona nel ridurre le dimensioni del reservoir è una ART molto precoce, iniziata appena dopo l’infezione, senza dar tempo al reservoir di assumere grandi dimensioni.
Dal momento però che la maggior parte delle persone cominciano la terapia quando ormai sono in fase cronica, bisogna seguire altre vie per ottenere almeno una riduzione del reservoir latente. Di queste vie parliamo ogni giorno, quindi lascio che siano le due prossime slide di Günthard a sintetizzarle:

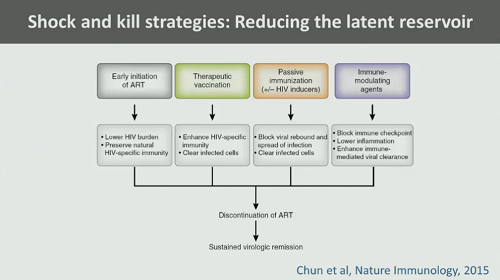
Che cosa abbiamo visto fino ad oggi nelle sperimentazioni cliniche delle sostanze anti-latenza? Risultati abbastanza deludenti: piccoli aumenti dell’HIV RNA nel plasma, ma nessuna reale diminuzione del reservoir. Vedremo che cosa ci racconteranno le presentazioni a questo CROI (Günthard dice di aspettarsi molto dalla presentazione dei danesi su Vacc-4x e romidepsina – ma io vi sconsiglio di puntarci sopra grosse cifre).

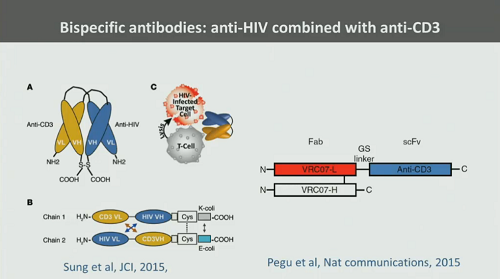
Segue lo “shock and kill” insieme ad anticorpi. Le DART e in generale gli anticorpi bispecifici promettono molto, speriamo riescano anche a mantenere:
Infine l’impedimento al virus ad entrare nelle cellule. Il blocco del CCR5 può avvenire per via farmacologica (cioè extracellulare), oppure per via di terapia genica. Sono anche queste ricerche che seguiamo dai loro esordi.
A conclusione della lezione Günthard ci lascia qualche idea su cui riflettere:
In definitiva, dice Günthard, la ART funziona benissimo, ancor meglio di quanto ci si potesse attendere anche solo 10 anni fa, abbiamo alle viste una cura funzionale indotta da una terapia molto precoce, anche se non sappiamo quanto possa durare. Invece, un’eradicazione dell’infezione è ancora abbastanza lontana. Ma ci si arriverà.
La montagna qui sotto è metà svizzera, metà italiana. La parte bella è svizzera, dice Günthard.

Il 12° Workshop per nuovi ricercatori, come gli 11 precedenti, ha lo scopo di sintetizzare lo stato dell’arte di alcune aree della ricerca di base e della ricerca clinica su HIV, presentando alcuni dei temi principali che saranno discussi durante il congresso.
Huldrych Günthard, dell’University Hospital di Zurigo, ha tenuto una lezione sul reservoir latente di HIV, sugli ostacoli che questo presenta al raggiungimento di una cura e sulle strategie che si stanno disegnando per superare questi ostacoli.
Per i frequentatori abituali di questa sezione del forum sui congressi e di Verso una Cura, solo un ripasso. Per chi si affaccia adesso a queste ricerche, spero sia un utile punto di partenza.
Günthard esordisce ricordando come il reservoir di HIV sia un enigma, perché è vero che la questione sembra semplice – il provirus di HIV si integra nella cellula ospite e le cellule latentemente infette se ne stanno lì per molto, molto tempo, obbligando ad assumere antiretrovirali a vita. Ed è vero che l’obiettivo sembra obbligato: per curare l’infezione da HIV si deve eliminare il reservoir latente. Ma la sfida è ancora aperta: quanto è grande il reservoir? Come facciamo ad arrivarci? Come facciamo a distruggerlo?

È da almeno il 1996 che sappiamo che virtualmente in ogni persona in terapia antiretrovirale è possibile rilevare cellule infette che contengono il DNA del virus (cioè il provirus).
Nel 1997,poi, sono state individuate cellule che non soltanto contengono HIV DNA “latente”, ma HIV DNA capace di replicarsi. Questo diede la conferma che un reservoir di HIV persiste durante la terapia.
Fra gli ostacoli alla cura sono da elencare:
1. La completa localizzazione del reservoir di HIV, che può essere localizzato in cellule – quindi bisogna capire esattamente in quali cellule e quale contributo queste diano all’estensione complessiva del reservoir:

ma anche in comparti anatomici – sistema nervoso centrale, linfonodi e tessuti linfatici, altri organi:

2. La difficoltà per la ART di avere accesso al reservoir latente: esistono test molto sensibili, che riescono a rilevare HIV RNA nel plasma anche dopo diversi anni di soppressione della viremia grazie alla terapia combinata.
Già dall’inizio degli anni 2000 sappiamo che se si comincia la ART durante la fase acuta dell’infezione si ha una viremia residua di molto inferiore che se si comincia durante la fase cronica e soprattutto se la si comincia quando ormai si è raggiunto uno stato di immunosoppressione. Ma tutti i trattamenti antiretrovirali lasciano comunque del virus residuo.
C’è un certo decadimento della viremia residua nei primi anni di ART, ma poi questo sostanzialmente si ferma e il livello di RNA virale rilevabile nel sangue, per quanto bassissimo, rimane costante.

Ma anche l’RNA virale associato alle cellule (cioè non circolante libero nel plasma) persiste durante la ART ed è rilevabile nelle cellule mononucleate del sangue periferico (PBMC), nei linfonodi e nella mucosa intestinale anche dopo anni di terapia.
3. La caratterizzazione dettagliata del reservoir di HIV: abbiamo cellule che davvero sono latentemente infette, che contengono dell’HIV DNA e minime, se non nulle, quantità di RNA trascritto; poi abbiamo cellule parzialmente attivate ma senza produzione di virus, che contengono HIV DNA e bassissimi livelli di RNA virale trascritto (in sostanza solo proteine come Tat, Rev e Nef); e infine abbiamo cellule in cui l’infezione è produttiva e che contengono sì provirus, ma anche alti livelli di RNA trascritto, e dunque producono effettivamente virioni e possono essere inibite dalla terapia antiretrovirale. Il gruppo di mezzo è quello più difficile da descrivere.

Nella slide che segue Günthard mostra un esempio di classificazione delle cellule infette in base al tipo di infezione (se con HIV DNA o RNA, e se HIV RNA a quali livelli di trascrizione), in base al tempo necessario a distruggere queste cellule quando si comincia la ART e poi negli anni successivi (nella tabella si va dalle più difficili da distruggere alle più facili). Quello che Günthard tiene a sottolineare è che la presenza di HIV RNA in una cellula non comporta necessariamente replicazione del virus:

Come ha anticipato all’inizio della lezione, il decadimento del DNA provirale è estremamente lento e quasi si ferma dopo il primo anno di terapia: all’inizio il provirus non integrato sparisce in fretta e quel che poi rimane e persiste nel tempo è soprattutto DNA integrato nel genoma della cellula.

Siliciano ha stimato che il tempo necessario ad eradicare un reservoir di 100.000 cellule sia di 60 anni:

4. Perché tutto questo? Perché il decadimento del reservoir si ferma dopo circa un anno di terapia?
Le ragioni possono essere sostanzialmente due (e non alternative):
- - perché le cellule latentemente infette hanno un tempo di vita molto lungo;
- perché c’è qualcosa che dall’esterno continua a riempire il reservoir.

Günthard elenca dunque le ragioni a favore e contro la replicazione di basso livello, ricordando come tutte siano sostenute da mote ricerche (tonnellate di ricerche – dice Günthard).
PRO:
- - l’evoluzione di specifici comparti anatomici durante la ART;
- il rilevamento di transitori circoli 2-LTR [segnale di replicazione attiva] dopo intensificazione della ART;
- la diminuzione dell’HIV RNA unspliced nell’ileo terminale dopo intensificazione della ART con Raltegravir;
- la replicazione residua dovuta alla diffusione da cellula a cellula nei linfonodi (che per Günthard è stata ipotizzata, ma non dimostrata);
- i livelli subottimali raggiunti dai farmaci nei linfonodi (che sono stati direttamente misurati);
- l’evoluzione del virus nel tessuto linfatico pur in presenza di ART (una novità).
CONTRO:
- - l’assenza di evoluzione in virus isolati dal reservoir latente, nei linfonodi dopo due anni di ART soppressiva e dalle PBMC;
- l’assenza di evoluzione nei virus ricomparsi al momento del rebound durante la ART e dopo l’interruzione della terapia;
- la quasi totale assenza di effetto dell’intensificazione della ART sul reservoir latente;
- il riempimento del reservoir latente mediante espansione clonale;
- un’espansione clonale dovuta prevalentemente a cellule che ospitano un virus almeno parzialmente difettivo;
- il fatto che non emergano resistenze di grande entità a livello di popolazioni.
Quest’ultimo punto sarà discusso al CROI in uno studio sulla coorte svizzera (quindi 10.000 pazienti in terapia nel mondo reale), da cui si è osservato che, nel corso dell’ultimo decennio, l’emergenza di resistenze si è quasi fermata.

5. Quali sono i fattori determinanti per la persistenza del reservoir latente? Mentre di alcuni siamo sicuri, per confermare altri serve più ricerca:
- - i CD4 memoria infetti, che hanno una vita molto lunga;
- l’espansione clonale dei CD4 quiescenti infetti;
- forse i santuari anatomici, dei quali sappiamo troppo poco, anche perché non possiamo indagarli se non attraverso metodi invasivi come le biopsie;
- forse una replicazione di basso livello;
- forse i macrofagi e altri reservoir cellulari, che secondo Günthard stanno in una “zona grigia”.

6. Quello che rileviamo è davvero un reservoir? Molto del virus contenuto in cellule latentemente infette è difettivo, quindi non riesce a replicarsi.

7. Come si fa a misurare il reservoir? Dobbiamo andare a stimarlo nel plasma o in altri liquidi biologici, dove troviamo sostanzialmente la viremia residua? Oppure si annida soprattutto nelle PBMC? E che cosa possiamo dire dei tessuti?

E con quali tipi di test è meglio misurarlo? Sappiamo che sia i metodi basati sulla PCR, sia i viral ourgrowth assay (VOA) hanno dei limiti e dei problemi.

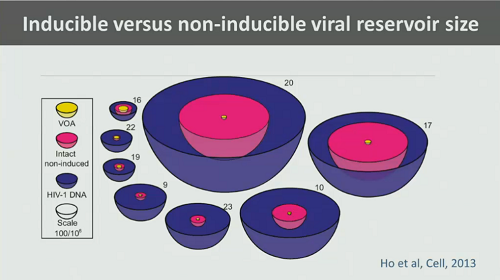
Poi Günthard ricorda un lavoro del Siliciano Lab di caratterizzazione e di distinzione del provirus in inducibile e non inducibile (cioè capace o meno di trascriversi) di cui abbiamo parlato tante volte. E ricorda come il VOA sovrastimi il virus capace di replicazione, mentre la PCR non sia in grado di distinguere fra provirus inducibile e provirus difettivo.

Le sfide tecniche sono molte e diverse:
- - se cerchiamo di misurare il reservoir latente partendo dal sangue periferico, riusciamo a catturarne solo una porzione molto piccola (circa l’1%);
- i reservoir anatomici sono difficili da raggiungere con esami di routine;
- i VOA misurano solo una frazione di provirus capace di replicarsi (arrivando a sottostimare il reservoir di 60 volte);
- se misuriamo il reservoir che può essere indotto usando gli RNA trascritti, questi non riflettono esattamente il virus capace di replicazione;
- il DNA provirale difettivo è tantissimo (la PCR dunque stima un reservoir di circa 2 log più grande rispetto a quello stimato dal VOA).
Per stimare il reservoir e predire il tempo di rebound della viremia quando si sostiene la ART si può usare il DNA virale, che viene utilizzato anche per valutare la progressione della malattia. Non è esente da limitazioni, ma in mancanza di meglio continua ad essere usato, soprattutto se si ha a che fare con grandi numeri di pazienti.
Di fatto, tutti i test ad oggi disponibili danno soltanto una stima surrogata del reservoir latente e l’unico modo per sapere se un intervento di cura ha avuto successo è interrompere la ART e stare a vedere che cosa succede, con tutti i rischi connessi a un rebound improvviso della viremia.

Dopo avere descritto gli ostacoli, Günthard dedica l’ultima parte della sua lezione alle strategie di cura e ricorda il primo tentativo – che definisce “eroico” – di svuotare il reservoir di persone in terapia usando insieme anticorpi anti-CD3 e l’IL-2. Era il 1999 il tentativo pionieristico si risolse in un disastro: il reservoir se ne rimase com’era, in compenso i pazienti ebbero effetti collaterali tremendi.
Quello che oggi sappiamo che funziona nel ridurre le dimensioni del reservoir è una ART molto precoce, iniziata appena dopo l’infezione, senza dar tempo al reservoir di assumere grandi dimensioni.

Dal momento però che la maggior parte delle persone cominciano la terapia quando ormai sono in fase cronica, bisogna seguire altre vie per ottenere almeno una riduzione del reservoir latente. Di queste vie parliamo ogni giorno, quindi lascio che siano le due prossime slide di Günthard a sintetizzarle:


Che cosa abbiamo visto fino ad oggi nelle sperimentazioni cliniche delle sostanze anti-latenza? Risultati abbastanza deludenti: piccoli aumenti dell’HIV RNA nel plasma, ma nessuna reale diminuzione del reservoir. Vedremo che cosa ci racconteranno le presentazioni a questo CROI (Günthard dice di aspettarsi molto dalla presentazione dei danesi su Vacc-4x e romidepsina – ma io vi sconsiglio di puntarci sopra grosse cifre).

Segue lo “shock and kill” insieme ad anticorpi. Le DART e in generale gli anticorpi bispecifici promettono molto, speriamo riescano anche a mantenere:

Infine l’impedimento al virus ad entrare nelle cellule. Il blocco del CCR5 può avvenire per via farmacologica (cioè extracellulare), oppure per via di terapia genica. Sono anche queste ricerche che seguiamo dai loro esordi.
A conclusione della lezione Günthard ci lascia qualche idea su cui riflettere:
- - il reservoir latente di HIV deve essere distrutto (qual è il modo migliore? – lui ammette di non saperlo);
- le dimensioni del reservoir non sono ancora del tutto chiare (prevalentemente perché non sappiamo bene come misurarlo);
- è dal 1997 che si continua a discuterne: esiste o no un basso livello di replicazione durante la ART?
- un basso livello di replicazione metterebbe a rischio gli approcci di tipo “shock and kill”, perché questi per avere successo hanno bisogno di una completa inibizione della replicazione virale e che non si verifichino nuovi cicli di infezione dopo che il reservoir è stato riattivato;
- al momento, l’unica possibilità di ridurre il reservoir latente è una ART davvero precoce.
In definitiva, dice Günthard, la ART funziona benissimo, ancor meglio di quanto ci si potesse attendere anche solo 10 anni fa, abbiamo alle viste una cura funzionale indotta da una terapia molto precoce, anche se non sappiamo quanto possa durare. Invece, un’eradicazione dell’infezione è ancora abbastanza lontana. Ma ci si arriverà.
La montagna qui sotto è metà svizzera, metà italiana. La parte bella è svizzera, dice Günthard.
