Dora ha scritto:GSK a gennaio ha completato una fase I e contemporaneamente ha iscritto una nuova sperimentazione su un inibitore della maturazione che si chiama GSK2838232 - NCT03045861 - che non è ancora aperta al reclutamento dei partecipanti, ma si dovrebbe concludere il prossimo maggio. E che è un ritorno indietro: una fase IIa proof of concept di 10 giorni di monoterapia a maschi adulti naive, in aperto, con dosaggi scalati, e che si dividerà in 2 parti:La massima durata dello studio è di circa 6 mesi e secondo GSK già il prossimo maggio ci dovrebbero essere dei risultati sulla prima parte.
- - parte A: giorni 1-10, una combinazione di GSK2838232 potenziato da cobicistat una volta al giorno, somministrati a 10 pazienti per studiare sicurezza, tollerabilità, farmacocinetica ed effetto antivirale. Seguirà un'analisi ad interim dei dati;
- parte B: dopo il completamento dell'analisi ad interim e sulla base di quei dati, altri pazienti saranno arruolati in due o più coorti (20, 50 o 200 mg di inibitore della maturazione + 150 mg di cobicistat).
Che cosa sia questo GSK2838232 e in che cosa differisca da GSK353279, la cui sperimentazione sembra sia andata bene, ma che ciò nondimemo è stato bloccato, non so. Nel sito di GSK non c'è nulla al riguardo e quel che trovo in Google sono solo informazioni già viste.

Nuovi dati su sicurezza e tollerabilità dell'inibitore della maturazione di HIV GSK2838232
Jules Levin e Mark Mascolini riferiscono di dati presentati in questi giorni al 18th International Workshop on Clinical Pharmacology of Antiviral Therapy di Chicago sul nuovo inibitore della maturazione GSK2838232 e lo collegano al GSK2578999 presentato per la prima volta da GSK al CROI 2015, il cui poster può essere visto nel sito di Natap.
Due i lavori nuovi, svolti entrambi su gruppi di volontari sani:
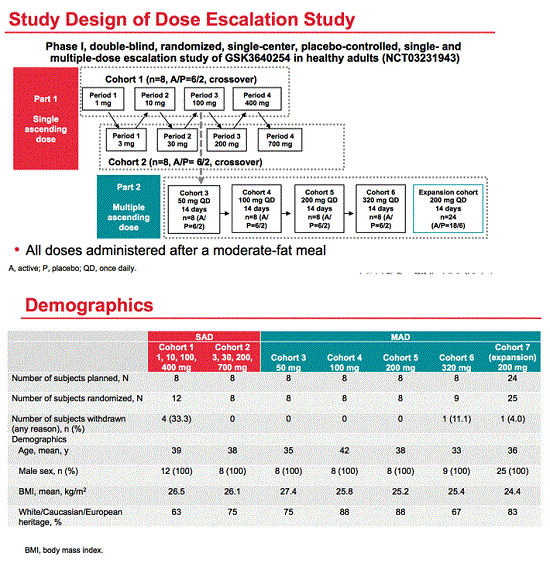
1. Early Safety, Tolerability and Pharmacokinetic Profile of GSK2838232, a Novel 2nd Generation HIV Maturation Inhibitor, as Assessed in Healthy Subjects, le cui slides immagino saranno presto pubblicate in Natap nella pagina dedicata al congresso e in cui le cose sono andate in sintesi così:
2. Safety and Concentrations of GSK Maturation Inhibitor With or Without Ritonavir - questo il report di Mascolini:
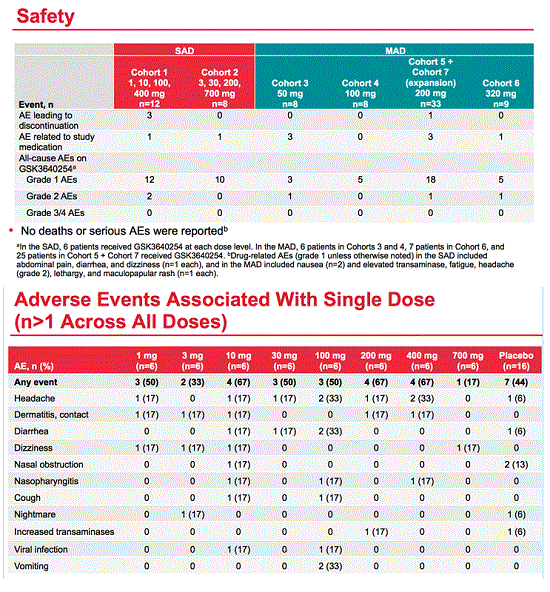
- A 100-mg ritonavir boost significantly raised exposure of GSK2838232, an HIV maturation inhibitor, in an analysis of four phase 1 dose-escalation and safety studies [1]. GSK investigators reported optimal plasma exposure of the investigational drug with repeated once-daily ritonavir-boosted dosing.
By binding the HIV Gag protein, maturation inhibitors induce formation of immature viral particles that cannot infect other cells [2]. No HIV maturation inhibitors have been licensed or reached phase 3 trials. In 2016 GSK abandoned development of another maturation inhibitor, BMS-955176, because of poor results in a phase 2 trial [3].
The analysis involved 124 healthy adults, 9 of them women, in four phase 1 trials outlined at ClinicalTrials.gov (NCT01802918, NCT02289482, NCT02289495, NCT02795754). Participants took single or repeat doses of GSK2838232 with or without a ritonavir boost. The trials tested both a solid formulation and an oral suspension. GSK2838232 doses ranged from 5 to 250 mg. One trial tested GSK2838232 for 11 days at doses up to 200 mg daily with 100 mg of ritonavir daily or 200 mg twice daily without ritonavir. Except for relative bioavailability assessments, the studies were placebo controlled.
Four volunteers withdrew from NCT02795754 for adverse events judged unrelated to GSK2838232. Adverse events possibly related to GSK2838232 were headache and dizziness. Some participants had rash, probably reflecting wearing ECG electrodes for continuous cardiovascular monitoring. Sporadic nonsustained ventricular tachycardia affected 1 participant and was judged unrelated to GSK2838232. Hematologic and other lab values did not change significantly with GSK2838232.
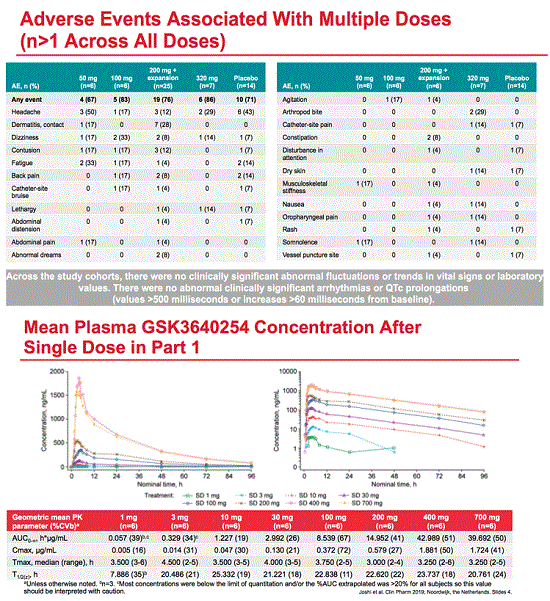
Unboosted repeat capsule doses of 200 mg twice daily with food resulted in trough concentrations above the target of 5 ng/mL. Once-daily single doses up to 100 mg and repeat doses up to 50 mg with an unoptimized suspension did not achieve target troughs.
Ritonavir boosting raised single-dose GSK2838232 area under the concentration-time curve (AUC) 10-fold and maximum concentration (Cmax) 3-fold. Half-life rose from about 20 hours to about 34 hours with ritonavir. The capsule formulation achieved higher GSK2838232 exposure than the powder suspension. Food increased AUC and Cmax about 60% with the capsule formulation of GSK2838232.
GSK investigators concluded that the pharmacokinetic profile of GSK2838232 indicates that the maturation inhibitor will maintain plasma concentrations above the protein-adjusted 90% inhibitory concentration for all HIV patients.
A phase 2 study of 10-day monotherapy with cobicistat-boosted GSK2838232 in antiretroviral-naive adults with HIV is under way [4]. This is the first study of boosting with cobicistat rather than ritonavir.
References
1. Johnson M, Jewell R, Peppercorn A, et al. Early safety, tolerability, and pharmacokinetic profile of GSK2838232, a novel 2nd generation HIV maturation inhibitor, as assessed in healthy subjects. 18th International Workshop on Clinical Pharmacology of Antiviral Therapy, June 14-17, 2017, Chicago. Abstract O_17.
2. APExBIO. GSK2838232 HIV-1 maturation inhibitor. http://www.apexbt.com/gsk2838232.html
3. Collins S. HIV i-Base. GSK discontinues development of maturation inhibitor BMS-955176. November 29, 2016. http://i-base.info/htb/30865
4. ClinicalTrials.gov. Safety and efficacy study of GSK2838232 in human immunodeficiency virus (HIV)-1 infected adults. ttps://clinicaltrials.gov/ct2/show/NCT03045861