PRO 140 in fase IIb
Re: PRO 140 in fase IIb
Non mi ero resa conto che fosse già passato un anno dall'ultimo aggiornamento sul PRO 140!
Mentre continua la sperimentazione in monoterapia, arriva l'ennesimo comunicato stampa di CytoDyn per dire che le cose vanno benissimo, splendidamente. Questa volta per i pazienti experienced in cui la ART funziona così-così e continua ad esserci una certa replicazione virale (HIV RNA ≥400 copie/mL): in uno studio randomizzato e in doppio cieco su 52 persone con HIV R5 e documentate resistenze ai regimi di ART che stavano prendendo, l'anticorpo + la ART avrebbe fatto meglio della ART + placebo (riduzioni della viremia di 0,5 log superiori rispetto al placebo dopo una settimana).
Avanti con calma, eh?
Maggiori dettagli qui: CytoDyn Reports Primary Endpoint Achieved in PRO 140 Pivotal Combination Therapy Trial in HIV Infection.
Mentre continua la sperimentazione in monoterapia, arriva l'ennesimo comunicato stampa di CytoDyn per dire che le cose vanno benissimo, splendidamente. Questa volta per i pazienti experienced in cui la ART funziona così-così e continua ad esserci una certa replicazione virale (HIV RNA ≥400 copie/mL): in uno studio randomizzato e in doppio cieco su 52 persone con HIV R5 e documentate resistenze ai regimi di ART che stavano prendendo, l'anticorpo + la ART avrebbe fatto meglio della ART + placebo (riduzioni della viremia di 0,5 log superiori rispetto al placebo dopo una settimana).
Avanti con calma, eh?
Maggiori dettagli qui: CytoDyn Reports Primary Endpoint Achieved in PRO 140 Pivotal Combination Therapy Trial in HIV Infection.
Re: PRO 140 in fase IIb
Brevi aggiornamenti sul PRO 140.
CytoDyn nei giorni scorsi ha presentato i risultati ad interim di un trial su 50 persone con HIV multiresistente all'ASM Microbe, l'incontro annuale della American Society for Microbiology, che si è tenuto ad Atlanta dal 7 all'11 giugno.
Dopo una sola iniezione dell'anticorpo (350 mg sottocute), in combinazione con la ART che stava funzionando male (con evidenze di replicazione virale e documentate resistenze a due o più classi di ARV), i pazienti hanno raggiunto una riduzione media della viremia del 97% rispetto alla viremia media di partenza.
È stato dunque soddisfatto l'obiettivo principale, che consisteva in una diminuzione di almeno 0,5 log dell'HIV RNA dopo una settimana dal trattamento (p ~ 0.0032).
Questa prima fase della sperimentazione era in cieco e con placebo.
Nella seconda parte del trial, questa volta in aperto, i partecipanti riceveranno una iniezione a settimana per 24 settimane insieme al loro regime di ART.
Maggiori dettagli in un report pubblicato da Healio:
CytoDyn nei giorni scorsi ha presentato i risultati ad interim di un trial su 50 persone con HIV multiresistente all'ASM Microbe, l'incontro annuale della American Society for Microbiology, che si è tenuto ad Atlanta dal 7 all'11 giugno.
Dopo una sola iniezione dell'anticorpo (350 mg sottocute), in combinazione con la ART che stava funzionando male (con evidenze di replicazione virale e documentate resistenze a due o più classi di ARV), i pazienti hanno raggiunto una riduzione media della viremia del 97% rispetto alla viremia media di partenza.
È stato dunque soddisfatto l'obiettivo principale, che consisteva in una diminuzione di almeno 0,5 log dell'HIV RNA dopo una settimana dal trattamento (p ~ 0.0032).
Questa prima fase della sperimentazione era in cieco e con placebo.
Nella seconda parte del trial, questa volta in aperto, i partecipanti riceveranno una iniezione a settimana per 24 settimane insieme al loro regime di ART.
Maggiori dettagli in un report pubblicato da Healio:
- According to the researchers, the participants’ mean baseline viral load was 4.32 log10. On average, participants were treated with at least 10 previous ARVs and were resistant to at least nine.
One week following a single injection of PRO 140, patients achieved a mean viral load reduction of approximately 97% from baseline. According to the researchers, the trial met its primary efficacy endpoint — the proportion of patients with at least 0.5 log10 reductions in HIV-1 RNA from baseline at the end of the 1-week treatment period (P < .01).
The researchers said PRO 140 was generally well-tolerated, and there have been no drug-related serious adverse events or treatment discontinuations reported to date. So far, 32 patients have completed the study, 17 are ongoing and three discontinued the study early. The researchers are providing continued access to PRO 140 to patients who completed 25 weeks of therapy.
References:
Dhody K, et al. Abstract AAR LB15. Presented at: ASM Microbe; June 7-11, 2018; Atlanta.
Maddon PJ, et al. Pro140 Sc monotherapy provides long-term, full virologic suppression in HIV patients. Presented at: ASM Microbe; June 16-20, 2016; Boston.
Re: PRO 140 in fase IIb
Il PRO 140 (leronlimab) è ormai in fase di approvazione per il trattamento dell'infezione da HIV, sia in combinazione con antiretrovirali, sia in monoterapia (in arrivo un grande trial clinico) per persone con HIV multiresistente.
Cytodyn sta studiando il farmaco anche nel cancro metastatico del seno (fase preclinica, modello animale) e ieri ha annunciato che ha iniziato a studiarlo in un modello di topi umanizzati anche per prevenire la progressione della NASH - steatoepatite non alcolica.
Questa mi pare una notizia interessante, alla luce della crescente importanzache la NASH sta assumendo in questi anni come co-patologia nelle persone con HIV: prendi uno, curi due.
Cytodyn sta studiando il farmaco anche nel cancro metastatico del seno (fase preclinica, modello animale) e ieri ha annunciato che ha iniziato a studiarlo in un modello di topi umanizzati anche per prevenire la progressione della NASH - steatoepatite non alcolica.
Questa mi pare una notizia interessante, alla luce della crescente importanzache la NASH sta assumendo in questi anni come co-patologia nelle persone con HIV: prendi uno, curi due.
Re: PRO 140 (leronlimab) in fase IIb
AGGIORNAMENTO SU LERONLIMAB (già PRO 140)
Nel riferire delle sperimentazioni, eravamo rimasti al 2018. Ad aprile di quell'anno, Cytodyn pubblicò su HIV Clinical Trials un articolo che riassumeva i risultati dei trial clinici di cui abbiamo parlato in questo thread:
PRO 140, a monoclonal antibody targeting CCR5, as a long-acting, single-agent maintenance therapy for HIV-1 infection
Da allora, sul fronte HIV sono seguiti periodici comunicati stampa che aggiornavano sulla progressiva durata delle monoterapie in persone con HIV multiresistenti, mentre la società ha sperimentato l'anticorpo anti-CCR5 nel trattamento di diverse altre patologie - dal cancro alla NASH. In particolare, quest'anno lo sta studiando per la cura della COVID-19 e ha ricevuto per questo dall'FDA l'autorizzazione ad usarlo come farmaco di emergenza nell'infezione da SARS-CoV-2.
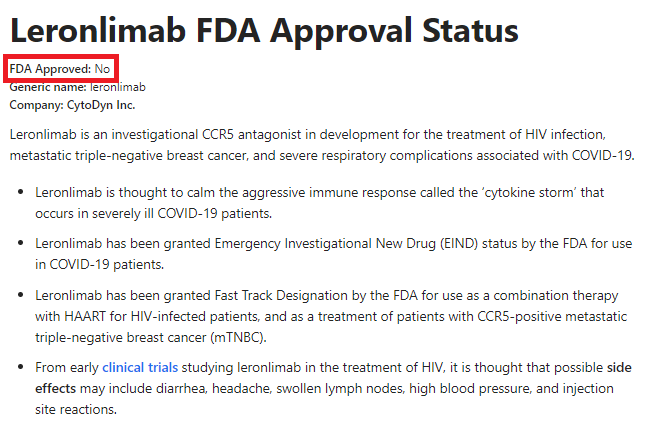
Ad oggi però, Leronlimab (il vecchio PRO 140), o Vyrologix™, come adesso lo chiama Cytodyn, non è ancora stato approvato dall'FDA.
Questa la situazione al momento:
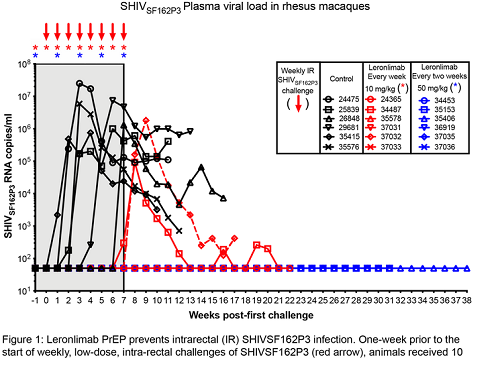
Ora Cytodyn comunica di avere stipulato un accordo con amfAR per studiare PRO 140-Leronlimab-Vyrologix nell'ambito della ricerca di una cura di HIV. L'idea è nata dopo che, in un lavoro presentato ad AIDS2020virtual, ma non ancora pubblicato, Cytodyn ha dimostrato che 4 macachi su 6 cui Leronlimab era stato somministrato come PrEP non si sono infettati nonostante molti tentativi di infettarli durati diverse settimane (le scimmie del gruppo di controllo, invece, si sono infettate tutte). Questo sembra che in qualche modo replichi il caso delle persone naturalmente prive di CCR5, nelle cui cellule il virus non riesce a penetrare e in cui, dunque, l'infezione abortisce.
A questo si deve aggiungere il fatto che la company sta studiando il leronlimab anche in uno studio clinico di fase II sul cancro per capire se, mascherando il CCR5 con l'anticorpo e quindi bloccando il ruolo di questo recettore nel processo infiammatorio, si evita quella cascata di citochine che si può verificare quando delle staminali allogeniche vengono trapiantate e si ha una reazione di rigetto, la Graf vs Host Disease, che può avere esiti gravissimi, sovente anche mortali.
Il proposito della partnership fra Cytodyn e amfAR è dunque quello di provare a somministare l'antagonista del CCR5 a persone che ricevono un trapianto di staminali CCR5+ (cioè wild type, non difettive CCR5Δ32), così da bloccare il co-recettore dell'HIV su di esse e sulle cellule che da esse derivano e cercare di replicare il successo del Berlin e del London Patient.
Per adesso, un trial iscritto in ClinicalTrials.gov ancora non c'è.
Seguiranno aggiornamenti.
Nel riferire delle sperimentazioni, eravamo rimasti al 2018. Ad aprile di quell'anno, Cytodyn pubblicò su HIV Clinical Trials un articolo che riassumeva i risultati dei trial clinici di cui abbiamo parlato in questo thread:
PRO 140, a monoclonal antibody targeting CCR5, as a long-acting, single-agent maintenance therapy for HIV-1 infection
Da allora, sul fronte HIV sono seguiti periodici comunicati stampa che aggiornavano sulla progressiva durata delle monoterapie in persone con HIV multiresistenti, mentre la società ha sperimentato l'anticorpo anti-CCR5 nel trattamento di diverse altre patologie - dal cancro alla NASH. In particolare, quest'anno lo sta studiando per la cura della COVID-19 e ha ricevuto per questo dall'FDA l'autorizzazione ad usarlo come farmaco di emergenza nell'infezione da SARS-CoV-2.
Ad oggi però, Leronlimab (il vecchio PRO 140), o Vyrologix™, come adesso lo chiama Cytodyn, non è ancora stato approvato dall'FDA.
Questa la situazione al momento:

Ora Cytodyn comunica di avere stipulato un accordo con amfAR per studiare PRO 140-Leronlimab-Vyrologix nell'ambito della ricerca di una cura di HIV. L'idea è nata dopo che, in un lavoro presentato ad AIDS2020virtual, ma non ancora pubblicato, Cytodyn ha dimostrato che 4 macachi su 6 cui Leronlimab era stato somministrato come PrEP non si sono infettati nonostante molti tentativi di infettarli durati diverse settimane (le scimmie del gruppo di controllo, invece, si sono infettate tutte). Questo sembra che in qualche modo replichi il caso delle persone naturalmente prive di CCR5, nelle cui cellule il virus non riesce a penetrare e in cui, dunque, l'infezione abortisce.

A questo si deve aggiungere il fatto che la company sta studiando il leronlimab anche in uno studio clinico di fase II sul cancro per capire se, mascherando il CCR5 con l'anticorpo e quindi bloccando il ruolo di questo recettore nel processo infiammatorio, si evita quella cascata di citochine che si può verificare quando delle staminali allogeniche vengono trapiantate e si ha una reazione di rigetto, la Graf vs Host Disease, che può avere esiti gravissimi, sovente anche mortali.
Il proposito della partnership fra Cytodyn e amfAR è dunque quello di provare a somministare l'antagonista del CCR5 a persone che ricevono un trapianto di staminali CCR5+ (cioè wild type, non difettive CCR5Δ32), così da bloccare il co-recettore dell'HIV su di esse e sulle cellule che da esse derivano e cercare di replicare il successo del Berlin e del London Patient.
Per adesso, un trial iscritto in ClinicalTrials.gov ancora non c'è.
Seguiranno aggiornamenti.
Re: PRO 140 in fase IIb
è drug repurposing con qualche razionale o una mossa disperata per non buttare l'investimento? chi lo sa...
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: PRO 140 in fase IIb
Il razionale potrebbe anche esserci, se pensi che il maraviroc, che è pure lui un antagonista del CCR5, è stato studiato sia per la PrEP, sia in vitro come sostanza anti-latenza, soprattutto dagli spagnoli di Santiago Moreno. Però del maraviroc si sono anche un po' perse le tracce, tanto che non ci sono sperimentazioni attive in ClinicalTrials.gov.
In ogni caso, Cytodyn è una di quelle company che amano fare dell'hype il loro registro comunicativo, quindi bisogna fare la tara qualunque cosa dicano.
Re: PRO 140 in fase IIb
Ieri Cytodyn ha comunicato che FDA ha imposto una sospensione totale del trial in corso del leronlimab in persone con Covid grave e una sospensione parziale dei trial su HIV, che sono un'estensione di sperimentazioni di fase II/III già concluse negli scorsi anni (e che avrebbero dovuto portare all'approvazione di un farmaco di cui ci occupiamo - mi pare - almeno dal 2010). Questo significa che non vengono né verranno in futuro arruolati altri pazienti Covid, mentre i pazienti HIV passano ad altra terapia.
Il comunicato non dava nessuna motivazione.
Durante una conference call che ho ascoltato poco fa, hanno solo spiegato che la sospensione è stata imposta a causa di problemi di sicurezza insorti in pazienti Covid.
La company, però, ha gravi problemi interni, ben delineati in questi articoli pubblicati ieri da Seeking Alpha e oggi da Endpoints News:
CytoDyn: Holding Onto The Ruins From An End Of An Era
After an RTF and some stern warnings, FDA slaps CytoDyn with two clinical hold
È dunque possibile che la travagliatissima storia del PRO 140/leronlimab si concluda qui.
Il comunicato non dava nessuna motivazione.
Durante una conference call che ho ascoltato poco fa, hanno solo spiegato che la sospensione è stata imposta a causa di problemi di sicurezza insorti in pazienti Covid.
La company, però, ha gravi problemi interni, ben delineati in questi articoli pubblicati ieri da Seeking Alpha e oggi da Endpoints News:
CytoDyn: Holding Onto The Ruins From An End Of An Era
After an RTF and some stern warnings, FDA slaps CytoDyn with two clinical hold
È dunque possibile che la travagliatissima storia del PRO 140/leronlimab si concluda qui.
Re: PRO 140 in fase IIb
Con un ricco finanziamento (fino a 5 milioni di dollari in 5 anni) da parte del NIAID (National Institute of Allergy and Infectious Disease), Jonah Sacha, un ricercatore del Vaccine and Gene Therapy Institute e dell' Oregon National Primate Research Center presso la Oregon Health & Science University (OSHU), studierà il leronlimab come una sorta di terapia genica.
Sempre studiandolo nei macachi, Sacha e colleghi l'anno scorso hanno dimostrato che questo anticorpo, bloccando il CCR5, riusciva a funzionare da PrEP e impedire ripetuti tentativi di trasmissione di un virus chimera SHIV attraverso le mucose.
Ora - come si fa nella terapia genica - useranno un vettore basato su un virus adeno-associato (AVV) sintetico per stimolare la produzione di leronlimab all'interno del corpo di un gruppo di macachi e così fare in una sola volta quello che la somministrazione esogena dell'anticorpo fa in più volte: bloccare l'accesso al virus nelle cellule che esprimono il co-recettore CCR5.
E vedremo se questo riuscirà a dare nuova vita al vecchissimo e finora assai sfortunato PRO 140 o se sarà solo l'ennesima giravolta in una storia ormai di una lunghezza così spropositata da sembrare epica.
Sempre studiandolo nei macachi, Sacha e colleghi l'anno scorso hanno dimostrato che questo anticorpo, bloccando il CCR5, riusciva a funzionare da PrEP e impedire ripetuti tentativi di trasmissione di un virus chimera SHIV attraverso le mucose.
Ora - come si fa nella terapia genica - useranno un vettore basato su un virus adeno-associato (AVV) sintetico per stimolare la produzione di leronlimab all'interno del corpo di un gruppo di macachi e così fare in una sola volta quello che la somministrazione esogena dell'anticorpo fa in più volte: bloccare l'accesso al virus nelle cellule che esprimono il co-recettore CCR5.
E vedremo se questo riuscirà a dare nuova vita al vecchissimo e finora assai sfortunato PRO 140 o se sarà solo l'ennesima giravolta in una storia ormai di una lunghezza così spropositata da sembrare epica.
Re: PRO 140 in fase IIb
Comunicato stampa di Cytodyn:Dora ha scritto: ↑giovedì 31 marzo 2022, 14:03Ieri Cytodyn ha comunicato che FDA ha imposto una sospensione totale del trial in corso del leronlimab in persone con Covid grave e una sospensione parziale dei trial su HIV, che sono un'estensione di sperimentazioni di fase II/III già concluse negli scorsi anni (e che avrebbero dovuto portare all'approvazione di un farmaco di cui ci occupiamo - mi pare - almeno dal 2010). Questo significa che non vengono né verranno in futuro arruolati altri pazienti Covid, mentre i pazienti HIV passano ad altra terapia.
Il comunicato non dava nessuna motivazione.
Durante una conference call che ho ascoltato poco fa, hanno solo spiegato che la sospensione è stata imposta a causa di problemi di sicurezza insorti in pazienti Covid.
La company, però, ha gravi problemi interni, ben delineati in questi articoli pubblicati ieri da Seeking Alpha e oggi da Endpoints News:
CytoDyn: Holding Onto The Ruins From An End Of An Era
After an RTF and some stern warnings, FDA slaps CytoDyn with two clinical hold
È dunque possibile che la travagliatissima storia del PRO 140/leronlimab si concluda qui.
CytoDyn Announces Voluntary Withdrawal of BLA for HIV-MDR Due to CRO Data Management Issues
In breve, rinunciano ad avanzare una Biologics License Application (BLA) per l'utilizzo del leronlimab come parte di una terapia combinata per persone con HIV multiresistente (continueranno invece le pratiche presso la FDA per le altre indicazioni dell'anticorpo - contro HIV, NASH, cancro).
La rinuncia avviene a seguito dell'ammissione da parte della company che i dati generati e raccolti nelle sperimentazioni cliniche sono di qualità insufficiente. Insomma, hanno fatto pessime sperimentazioni, quindi i risultati di quei trial non sono utilizzabili per richiedere l'approvazione e l'immissione in commercio del vecchio PRO 140.
No comment.
Re: PRO 140 in fase IIb
The Crime Report riferisce che mercoledì scorso un gran giurì federale nel Maryland ha accusato due uomini di aver cospirato per frodare gli investitori di CytoDyn.
Nader Pourhassan, che all'epoca dei fatti era presidente e CEO della società, e Kazem Kazempour, co-fondatore, presidente e CEO di Amarex Clinical Research LLC, una company che si è occupata delle sperimentazioni cliniche di CytoDyn e dei rapporti con la Food & Drug Administration, sono accusati di avere dato false informazioni agli investitori sui progressi delle ricerche sul PRO 140 (leronlimab). Sono inoltre stati accusati di insider trading e di violazione di regolamenti antifrode federali e di leggi federali sugli strumenti finanziari.
In sostanza, avrebbero dato agli investitori false speranze sulle possibilità del PRO 140 di arrivare all'approvazione al commercio da parte dell'FDA, pur essendo perfettamente consapevoli che l'FDA l'approvazione non l'avrebbe mai data perché gli studi clinici sono falliti.
Dal Ministero della Giustizia americano:
Two Biotech CEOs Charged in Securities Fraud Schemes
Two Biotech Company Presidents Indicted in Maryland for Securities Fraud Schemes
La fine del PRO 140, dopo anni e anni e anni che ne seguivamo le vicende, era già triste da un punto di vista scientifico. Ora abbiamo la conferma che è anche miserabile.
Nader Pourhassan, che all'epoca dei fatti era presidente e CEO della società, e Kazem Kazempour, co-fondatore, presidente e CEO di Amarex Clinical Research LLC, una company che si è occupata delle sperimentazioni cliniche di CytoDyn e dei rapporti con la Food & Drug Administration, sono accusati di avere dato false informazioni agli investitori sui progressi delle ricerche sul PRO 140 (leronlimab). Sono inoltre stati accusati di insider trading e di violazione di regolamenti antifrode federali e di leggi federali sugli strumenti finanziari.
In sostanza, avrebbero dato agli investitori false speranze sulle possibilità del PRO 140 di arrivare all'approvazione al commercio da parte dell'FDA, pur essendo perfettamente consapevoli che l'FDA l'approvazione non l'avrebbe mai data perché gli studi clinici sono falliti.
Dal Ministero della Giustizia americano:
Two Biotech CEOs Charged in Securities Fraud Schemes
Two Biotech Company Presidents Indicted in Maryland for Securities Fraud Schemes
If convicted, Pourhassan and Kazempour each face a maximum penalty of 20 years in prison on each securities fraud and wire fraud count, and five years in prison on the conspiracy count. Kazempour also faces a maximum penalty of five years in prison on the false statement count.
La fine del PRO 140, dopo anni e anni e anni che ne seguivamo le vicende, era già triste da un punto di vista scientifico. Ora abbiamo la conferma che è anche miserabile.