ADVANCES IN HIV CURE
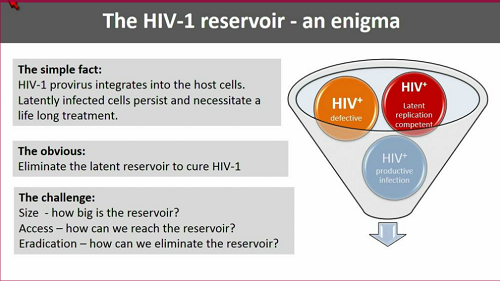
Günthard esordisce ammettendo l'estrema difficoltà dell'impresa di trovare una cura. Il vero, grande problema è il fatto che il provirus di HIV si integra nelle cellule e persiste in esse, imponendo la necessità di un trattamento continuo. Se l'obiettivo ovvio è l'eliminazione del reservoir latente composto da virus capace di replicarsi, le sfide da affrontare sono sostanzialmente tre:
- 1) come misurare le dimensioni del reservoir
2) come arrivare al reservoir
3) come eliminarlo
GLI OSTACOLI
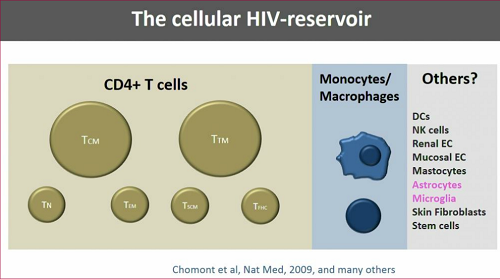
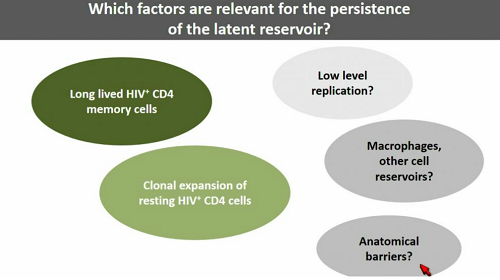
Definire in modo completo i reservoir cellulari: la maggior parte del reservoir risiede in diversi tipi di linfociti T CD4, nei monociti/macrofagi e in diversi tipi di altre cellule, alcuni dei quali non sono ancora stati individuati con certezza, che sappiamo che possono essere infettati, ma forse non sono in grado di sostenere una vera e propria infezione.
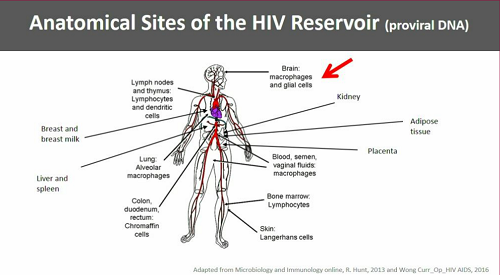
Ci sono poi i reservoir anatomici: tutti gli organi possono ospitare delle cellule infette, ma è soprattutto il cervello a costituire il maggiore reservoir anatomico, a causa dei macrofagi e delle microglia infetti. Questo è anche il reservoir più difficile da raggiungere con i farmaci (a questo reservoir il congresso dedica un intero simposio mercoledì).
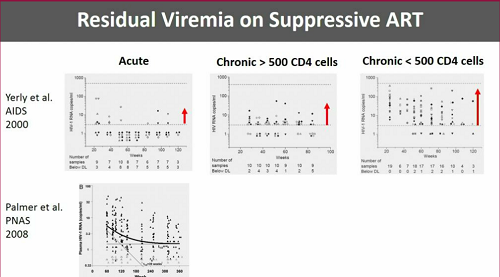
Il reservoir latente è inaccessibile alla ART e lo conferma il fatto che anche dopo anni di terapia antiretrovirale i test più sensibili riescano a rilevare dell'HIV RNA nel plasma.
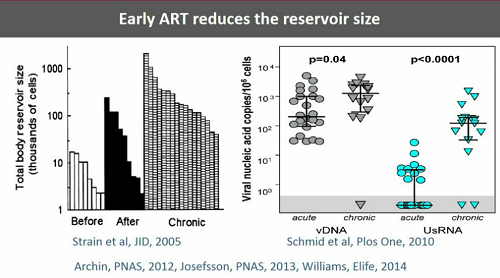
È però vero che se si trattano le persone durante la fase acuta dell'infezione la viremia residua è chiaramente più bassa che se si cominciano i trattamenti durante l'infezione cronica.
Anche l'HIV RNA associato alle cellule (ai CD4) persiste durante la ART e lo si può rilevare nelle PBMC, nei linfonodi e nell'intestino anche dopo molti anni di terapia.
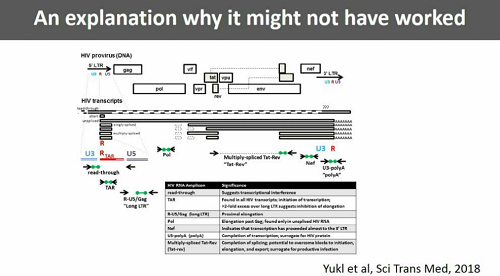
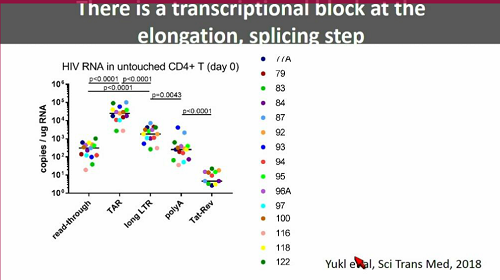
Günthard passa poi a parlare di un recentissimo articolo appena pubblicato su Science Translational Medicine: HIV latency in isolated patient CD4+ T cells may be due to blocks in HIV transcriptional elongation, completion, and splicing. Qui Yukl e colleghi hanno studiato diverse fasi del processo di trascrizione, costruendo un pattern trascrizionale del virus latente e osservando che lungo questo processo si verificano dei blocchi.
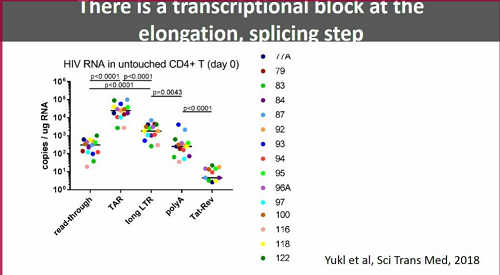
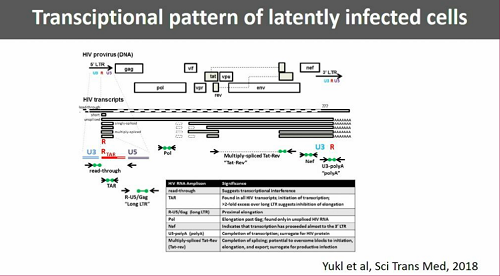
Le cellule che sono "davvero" latentemente infette contengono DNA provirale, molti trascritti TAR, dell'RNA virale unspliced, raro RNA spliced e presentano blocchi molto avanti nel processo di trascrizione.
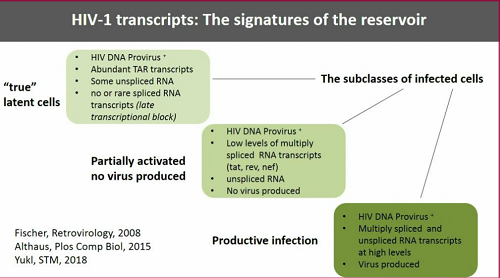
Le cellule che sono in parte attivate, ma senza produzione di virus, contengono DNA provirale, pochi trascritti di RNA spliced, RNA unspliced, senza però esprimere proteine virali.
Quando invece le cellule infette sostengono un'infezione produttiva, cioò stanno attivamente producendo virus, allora contengono DNA provirale e molti trascritti di RNA, sia unspliced, sia spliced.
Sappiamo che il decadimento del reservoir latente è molto lento e dunque, per esaurire il reservoir (ipotizzando che nel frattempo non venga rinnovato per altre vie) si dovrebbe ininterrottamente prendere la ART per 60 anni.
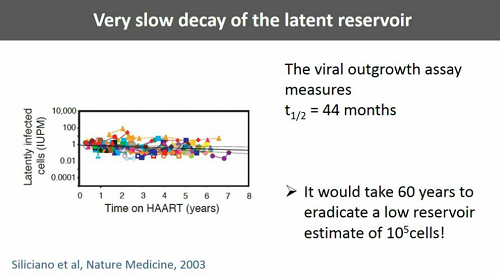
Perché un decadimento così lento? Le ragioni sono sostanzialmente due: 1) perché alcune delle cellule del reservoir vivono molto a lungo e, inoltre, si espandono per via clonale; 2) perché i bassi livelli di replicazione virale attiva che si mantengono durante la ART continuano a riempirlo.

Ci sono ragioni (e validi lavori) sia a favore sia contro la replicazione attiva durante la ART (la treza slide di questa serie le sintetizza gradicamente). Altri lavori verranno presentati al congresso.


COME E DOVE SI MISURA IL RESERVOIR
Lo si può misurare nel plasma (e in altri fluidi), oppure nei tessuti. Lo si può misurare valutando la viremia residua, oppure misurando l'RNA o il DNA virale associati alle cellule, il DNA virale totale, o integrato, o i circoli 2-LTR.
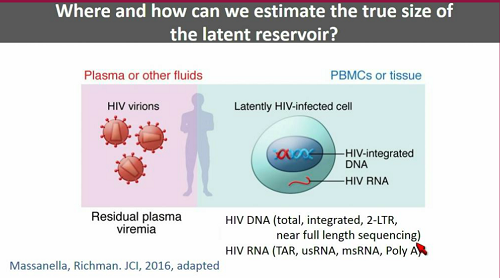
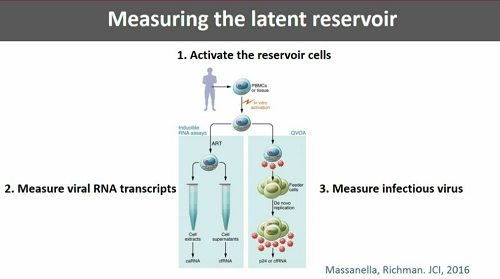
Una distinzione importante da fare è quella fra il virus integrato che può essere indotto a replicarsi (ed è dunque pienamente in grado di innescare nuovi cicli di infezione) e virus latente che è così mutato o danneggiato da non essere capace di replicazione. Questo è quello che costituisce la maggior parte del reservoir. Anche quest'anno ci saranno diverse presentazioni volte a caratterizzare la composizione del reservoir.
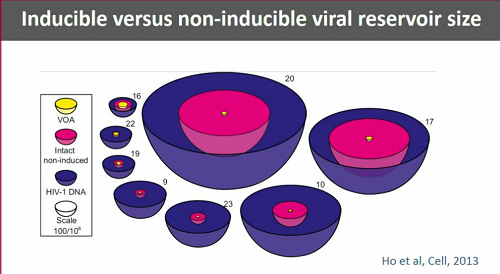
Günthard elenca poi le difficoltà tecniche connesse ai diversi tipi di test utilizzati per misurare diversi aspetti del reservoir e alla locallizzazione dei reservoir. Al momento, per sapere se un intervento ha funzionato, non esiste altro modo che interrompere la ART e stare ad aspettare il rebound della viremia.

DEFINIZIONE E STRATEGIE DI CURA
La cura può essere intesa o come controllo immuno-mediato della replicazione virale (cura funzionale), oppure come completa eliminazione del reservoir (eradicazione).

Le strategie per arrivare a una consistente riduzione del reservoir sono sostanzialmente quelle sintetizzate dalla prossima slide, meglio se combinate una con l'altra, mentre le slide che seguono offrono qualche dettaglio su ciascuna strategia [sono tutte ricerche di cui si parla diffusamente in tanti thread della sezione Verso una cura, quindi mi limito a riportare le diapositive]:
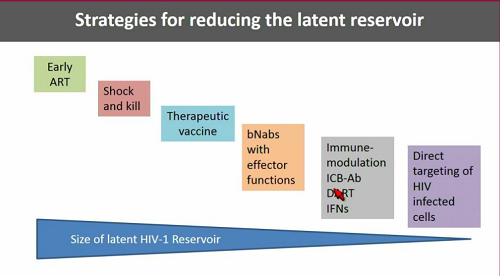
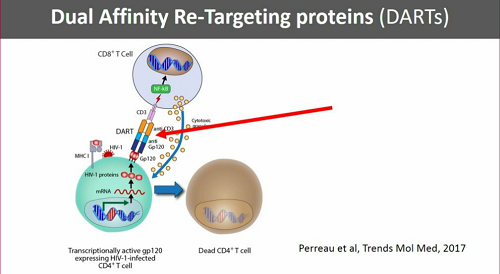
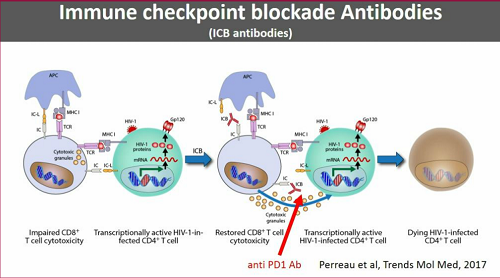
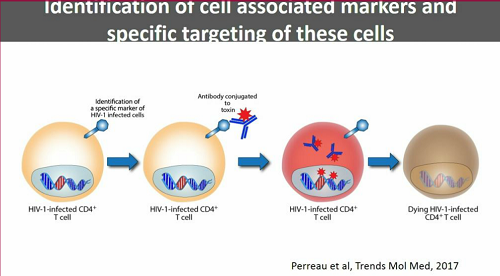
Per identificare le cellule latentemente infette e colpirle mediante qualche anticorpo, sarebbe molto utile avere un marker che permetta di distinguere le cellule infette da quelle non infette.
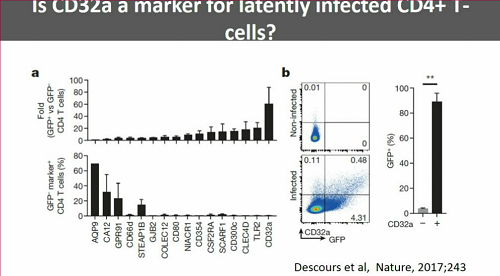
Günthard affronta dunque la molto imbarazzante questione del CD32, il marker che sembrava funzionare, ma che invece si è visto che, anzi, probabilmente indica cellule sane o infette, ma con replicazione attiva. Ci saranno tante presentazioni su questo al CROI - sembrano tutte confermare quanto si è visto al congresso di Miami sulla persistenza di HIV.
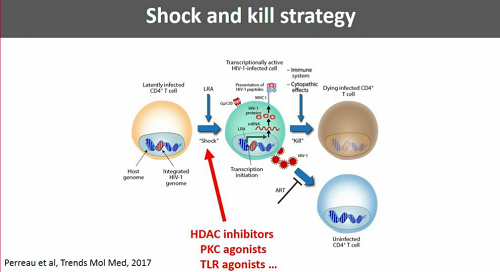
Fino ad ora, le strategie si shock and kill testate in vivo su esseri umani sono state piuttosto deludenti. La slide che segue mostra in sintesi quel che ci si aspettava e quel che, invece, si è potuto osservare:

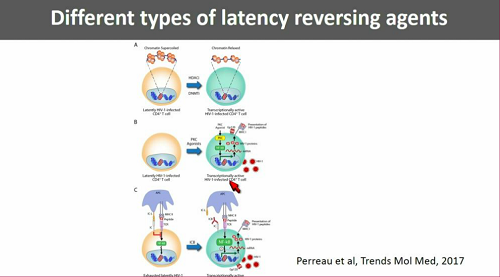
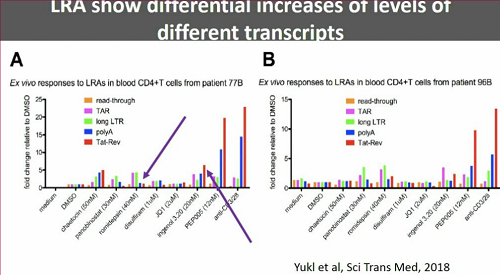
Una possibile ragione del fatto che in vitro si siano viste delle cose e in vivo tutt'altre potrebbe essere stata fornita dal lavoro di Yukl e colleghi menzionato prima, che ha mostrato come esistano dei blocchi nel processo di trascrizione del virus latente e come questi blocchi non siano "aggirati" dalle singole sostanze anti-latenza che sono già state sperimentate nei trial clinici (alcune ne aggirano uno, altre un altro - questa è un'altra ottima ragione per provare ad usare diversi farmaci anti-latenza insieme).
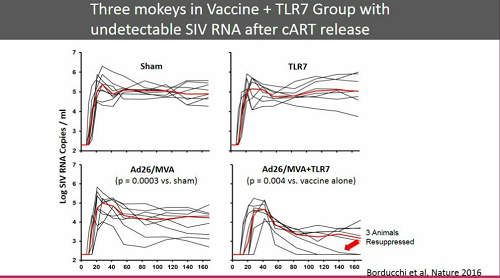
Fra le strategie combinate che sono già state studiate nei modelli animali, Günthard ne ricorda una, che ha avuto un certo successo nel mantenere la viremia soppressa dopo la sospensione della ART: un agonista del TLR7 insieme a un vaccino terapeutico Ad26/MVA.

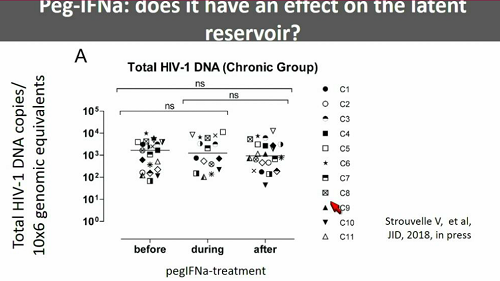
Un'altra strategia che è già stata sperimentata sull'uomo è quella con interferone-α. Finora non si sono visti risultati fantastici sul reservoi, ma è possibile che un interferone agisca in modo diverso dall'altro. Ce ne sono molti, quindi magari uno che funziona meglio lo si può trovare e vedremo diverse presentazioni al congresso.

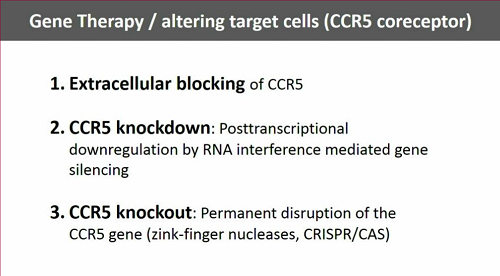
C'è infine la terapia genica, con la messa fuori gioco del corecettore CCR5, che HIV usa insieme al CD4 per penetrare nelle cellule. Gli studi in corso sono molti, sia su CD4, sia su staminali.
Le conclusioni con cui Günthard ci lascia sono una ripresa dei temi trattati nel corso della lezione e una conferma di quello che stiamo vedendo nelle sperimentazioni di questi ultimi anni: 1) se durante la ART permane della replicazione virale, questa può mettere a rischio qualunque strategia di tipo shock and kill; 2) la popolazione su cui si concentrano le maggiori speranze è quella delle persone che hanno avuto la fortuna di iniziare la ART prestissimo, durante l'infezione acuta.
