[CROI 2012] Alcuni report su latenza ed eradicazione
Inviato: domenica 18 marzo 2012, 11:19
Traduco una breve relazione che David Shepp, professore al North Shore University Hospital, Manhasset (New York), ha scritto per Natap sui lavori presentati al CROI relativamente a persistenza, latenza ed eradicazione dell’HIV. Chi fosse interessato ad alcuni approfondimenti, li trova qui:
CROI 2012: HIV Persistence, Latency and Eradication
La terapia antiretrovirale combinata sopprime in modo durevole la replicazione dell’HIV a dei livelli che consentono il miglioramento della funzione immunitaria, la libertà da malattie opportunistiche e aumentano enormemente l’aspettativa di vita. Tuttavia, non cura l’infezione da HIV. Molti pazienti continuano ad avere livelli molto bassi di HIV RNA nel sangue e nel tessuto linfatico. In quasi tutti i pazienti si possono rilevare genomi virali sotto forma di DNA provirale integrato nei linfociti T CD4 memoria, che hanno una lunga vita e che possono produrre HIV dopo che la cellula viene attivata.
Ad oggi, tutti i tentativi di sospendere la HAART, non importa quanto completa fosse la soppressione dell’HIV RNA e quanto a lungo fosse durata la terapia, hanno comportato un rebound virale e un deterioramento immunitario, nel giro di settimane o mesi. L’apparente cura di un singolo paziente (“il paziente tedesco”), che è rimasto libero da virus e senza HAART dopo aver ricevuto un trapianto allogenico di cellule staminali ematopoietiche per il trattamento di [una leucemia], ha stimolato un nuovo interesse a cercare una cura. Alcune ricerche si sono concentrate sulla completa eradicazione dell’HIV, mentre altri approcci aspirano a una cura “funzionale”, cioè uno stato in cui l’HIV rimane rilevabile, ma non si verifica progressione della malattia, anche in assenza di HAART.
Una sessione di abstract orali durante il CROI ha visto la presentazione di studi sulla persistenza, la latenza e l’eradicazione dell’HIV.
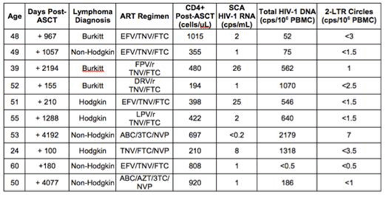
Eradicazione dell’HIV. Il trattamento del paziente tedesco è stato unico, perché il donatore delle staminali era omozigote CCR5Delta32, cioè le sue cellule erano prive di un co-recettore che è cruciale per l’ingresso dell’HIV. Non è chiaro se questo sia stato il fattore determinante per il successo della cura o se abbiano contribuito anche altri fattori. Cillo et al, abstr. 154 hanno valutato la presenza dell’HIV in 10 pazienti con linfoma associato all’HIV, che sono stati trattati con trapianto autologo di staminali. 9 pazienti su 10 continuavano ad avere HIV RNA rilevabile nel sangue e tutti avevano HIV DNA rilevabile nelle cellule. Questo studio suggerisce che la chemioterapia mieloablativa aggressiva, quale quella usata nel trapianto autologo, non sia in grado di eradicare l’HIV. Tuttavia, i regimi chemioterapici utilizzati con questi pazienti erano diversi da quello usato nel caso del paziente tedesco. Inoltre, questi pazienti non hanno ricevuto l’irradiazione total body, non hanno avuto Graft vs Host Disease – come invece può accadere nei trapianti allogenici – e sono state loro reinfuse le loro stesse staminali, che è possibile che fossero state contaminate da linfociti T infetti da HIV e che, per di più, non erano prive del recettore CCR5. Pertanto, l’aspetto principale che ha portato all’eradicazione del virus nel caso del paziente tedesco rimane da chiarire.
Quando i CD4 memoria, che ospitano del DNA provirale latente, vengono attivati, l’HIV RNA si esprime e si creano dei virioni. Nei pazienti in cui la HAART funziona, vengono impediti nuovi cicli di infezione. Tuttavia, le cellule che contengono DNA provirale latente non possono essere attivate in modo selettivo. Tentativi fatti in passato di ripulire il reservoir latente attraverso l’attivazione non selettiva dei linfociti T hanno comportato livelli di tossicità non accettabili. Questo ha spinto a cercare nuove strade per indurre l’espressione dell’HIV senza l’attivazione dei linfociti T. I meccanismi cellulari che controllano l’espressione dei geni non sono del tutto compresi, ma le iston-deacetilasi (HDAC) sono un’importante classe di enzimi, che aiutano a mantenere il legame del DNA con gli istoni, impedendo la trascrizione. Si è visto che dei farmaci che inibiscono gli HDAC riescono in vitro a forzare l’espressione genica dell’HIV nei linfociti T latentemente infetti, senza indurre attivazione dei T. Il vorinostat (VOR), chiamato anche SAHA, è un inibitore dell’HDAC approvato per il linfoma cutaneo dei linfociti T. Margolis, abstr. 157LB ha portato i risultati di un piccolo studio pilota (su 6 persone) in cui una singola dose di VOR è stata data a persone HIV+ aviremiche. L’espressione dell’HIV RNA è stata misurata nelle cellule ottenute per leucaferesi prima di somministrare il VOR, 4 ore e 8 ore dopo. L’HIV RNA è stato anche misurato nel plasma usando un single-copy assay molto sensibile. I livelli di espressione dell’HIV RNA nei CD4 quiescenti sono aumentati in modo significativo in tutti e 6 i pazienti dopo somministrazione di VOR, mentre i livelli di RNA nel plasma non sono stati modificati. Non si sono visti effetti avversi dipendenti dal farmaco. Questa è la prima dimostrazione in vivo di distruzione della latenza dell’HIV ed è incoraggiante. Tuttavia, i risultati sono preliminari. I ricercatori non hanno tentato di misurare le variazioni nella dimensione del serbatoio latente, perché si riteneva improbabile che ci fossero dei cambiamenti dopo una sola dose di trattamento. Il VOR è mutagenico nei batteri e nelle cellule dei mammiferi e aumenta il rischio di aborto e di malformazioni negli animali. Non è ancora chiaro se sia possibile arrivare a una riduzione del serbatoio latente o all’eradicazione, né quanto dovrebbe durare la terapia, né se il profilo di sicurezza del VOR permetterà a questa sostanza di essere utilizzata in studi di più lunga durata.
Lo studio sul VOR suggerisce che la distruzione della latenza sia possibile, ma i dati presentati in un altro studio suggeriscono che questa, da sola, possa non essere sufficiente a ridurre il serbatoio latente. Quando i CD4 memoria che contengono DNA provirale latente vengono attivati, essi subiscono un processo di apoptosi e vengono eliminati dal serbatoio latente. Il destino delle cellule che esprimono geni dell’HIV dopo il trattamento con un HDACi non è noto. Shan et al, abstr. 153 hanno isolato dei CD4 quiescenti da persone con HIV e li hanno trattati con VOR. Queste cellule, che sono rimaste nello stato di quiescenza, non sono state uccise dalla semplice riattivazione dell’HIV e sono rimaste vitali in coltura fino a 18 giorni. Quando alle colture dei CD4 latentemente infetti che erano stati trattati con VOR sono stati aggiunti dei CD8 autologhi, si è verificata l’uccisione dei CD4 infetti quando il donatore era un elite controller, cioè un paziente che mantiene i livelli plasmatici di HIV RNA al di sotto del limite di rilevamento senza la HAART. Le cellule degli elite controller avevano una buona attività citotossica dei linfociti T (CTL) spontanea. Invece, i CD8 di 7 su 8 donatori in HAART non avevano questa buona attività CTL e non riuscivano a uccidere i CD4 infetti. La stimolazione in vitro dei CD8 con dei peptidi dell’HIV ha migliorato l’attività CTL e l’uccisione delle cellule infette. Questo studio suggerisce che la distruzione della latenza con sostanze che non inducono attivazione dei linfociti T può non essere in grado di ridurre il reservoir latente. Aggiungere un’immunizzazione che stimoli l’attività CTL può essere necessario per uccidere le cellule infette dopo che si è indotta l’espressione genica dell’HIV.
Per ragioni di potenza, sicurezza e tollerabilità, le sostanze che si sa che interferiscono con la latenza dell’HIV possono non essere l’ideale. Probabilmente serviranno nuove sostanze. Xing et al, abstr. 156 hanno descritto un nuovo test per analizzare e identificare dei composti in grado di agire sulla latenza. Sono state identificate due classi di nuovi composti, che hanno proprietà di farmaci. Questi non inducono secrezione di citochine o attivazione dei linfociti T. Il loro meccanismo di azione non è ancora stato determinato.
L’inizio della HAART a uno stadio molto precoce dell’infezione può ridurre il serbatoio di cellule che ospitano HIV latente. Buzon et al, abstr. 151 hanno misurato periodicamente l’HIV DNA in pazienti da lungo tempo in HAART, che avevano iniziato la terapia in fase acuta (n=9), o cronica (n=26) e in elite controller (n=37). Hanno inoltre valutato il reservoir funzionale, usando un test di riattivazione in vitro. Anche un inizio precocissimo della HAART non ha evitato il formarsi di un reservoir latente. Tuttavia, i pazienti trattati durante la fase acuta avevano livelli di HIV DNA totale e integrato e livelli di riattivazione dell’HIV in vitro simili a quelli degli elite controller e notevolmente più bassi rispetto a quelli dei pazienti entrati in terapia durante la fase cronica.
Un secondo studio, presentato da Perelson et al, abstr. 152, ha utilizzato i dati di 27 pazienti trattati in fase acuta e un modello matematico per identificare delle correlazioni fra la viremia, la dinamica dei linfociti T e la dimensione del reservoir funzionale latente. I loro risultati hanno portato ulteriore sostegno all’idea che un inizio precoce della HAART limiti la dimensione del reservoir latente. Poiché in questi pazienti il serbatoio latente è più piccolo, coloro che iniziano la HAART in fase acuta potrebbero essere i migliori candidati per studi pilota che tentino di eradicare il virus.
Cura funzionale. Al CROI 2011, ci fu grande eccitazione per le relazioni iniziali sul transfer di linfociti T autologhi modificati in modo da renderli CCR5 negativi come terapia per l’HIV. Al congresso di quest’anno, Tebas et al, abstr. 155 hanno portato un aggiornamento di questo studio pilota. I CD4, raccolti mediante leucaferesi, di 21 pazienti con viremia controllata dalla HAART sono stati infettati ex vivo con un adenovirus incapace di replicazione, che ha fatto da vettore per portare una nucleasi a dita di zinco capace di bloccare il gene CCR5. Le cellule sono poi state espanse e re-infuse. Dopo l’infusione, si sono osservati rapidi e consistenti aumenti dei CD4; i pazienti che all’inizio dello studio avevano un maggior numero di CD4 hanno avuto gli incrementi maggiori. Tali incrementi non sono stati dovuti all’espansione delle cellule geneticamente modificate, che sono rimaste rilevabili a livelli medi attorno al 2%. Invece, è la stimolazione con diverse citochine che sembra responsabile dell’espansione dei linfociti T non modificati. Sei pazienti hanno interrotto la terapia per 12 settimane. Tutti hanno avuto rebound virali, seguiti da modesti declini. Uno dei 6 pazienti ha avuto transitoriamente livelli di HIV RNA non rilevabili, subito prima di riprendere la HAART. Quel paziente era eterozigote Delta 32 e presentava una proporzione di alleli CCR5 anomali molto più alta rispetto agli altri. Non ci sono stati dei controlli, quali per esempio pazienti trattati con infusioni di CD4 non modificati o senza infusioni, quindi è difficile capire se gli schemi osservati siano da attribuirsi alle cellule modificate. L’obiettivo di questo trattamento è una cura funzionale, grazie all’instaurarsi di uno stato chimerico con sia CD4 infetti, sia CD4 modificati geneticamente in modo da renderli resistenti all’HIV. Queste cellule resistenti potrebbero, in teoria, formare la base per una efficace risposta immune HIV-specifica, capace di controllare l’infezione da HIV nelle cellule non modificate; ma i dati sull’evoluzione di risposte immuni HIV-specifiche non sono stati presentati.
Le risposte immuni più efficaci contro l’HIV si sono viste associate con più bassi livelli di HIV RNA, più bassi livelli di attivazione immunitaria generalizzata, mantenimento di un numero normale di CD4 e non progressione della malattia. I componenti necessari per un’efficace risposta immunitaria non sono del tutto compresi, ma si è identificato di frequente, fra questi, il controllo virale grazie ai linfociti T CD8+. Queste risposte, in genere, sono basse o assenti in pazienti in cui l’infezione è a uno stadio avanzato. I CD8 inefficaci esprimono il marker di superficie PD-1, un sotto-regolatore delle risposte immuni e un segnale di esaurimento dei linfociti T. Velu et al, abstr. 158LB hanno indagato il potenziale terapeutico del blocco della PD-1 mediante una serie di infusioni di un anticorpo monoclonale anti-PD-1 in un modello di macachi infetti da SIV. In alcuni animali trattati, si è visto un miglioramento dell’attività anti-HIV dei CD8, con corrispondente declino nelle viremie, che non si è osservato nei controlli, che non erano stati trattati. Tuttavia, gli animali studiati erano pochissimi e non sono state fatte analisi statistiche, il che rende prematura ogni conclusione sull’attività di una terapia con anticorpi anti-PD-1.
Sintesi. David Ho e altri avevano previsto che l’HIV avrebbe potuto essere eradicato più o meno dopo 7 anni di HAART, e le prime stime sull’emivita del reservoir latente facevano pensare che questo sarebbe infine decaduto. Questa teoria era diffusa agli inizi dell’epoca della HAART. Ci furono degli studi fatti al NIAID e altrove che non riuscirono a rilevare HIV DNA nelle PBMC in alcuni pazienti dopo anni di HAART, quindi le terapie furono sospese; ma tutti ebbero un rebound. Ci sono voluti parecchi anni prima che prendesse piede la convinzione che la HAART da sola non avrebbe eradicato il virus. Dopo che vennero meno le speranze iniziali che un periodo prolungato di HAART da sola avrebbe infine eradicato l’HIV, la cura parve una possibilità davvero remota. La possibilità sia di eradicare, sia di giungere a una cura funzionale, è ancora abbastanza lontana, ma ora si riesce a discernere una via verso questi obiettivi. È stato trovato un farmaco capace di interrompere la latenza dell’HIV senza attivare i linfociti T, così come sono stati trovati degli strumenti per identificare nuove sostanze che agiscano meglio e siano più sicure. È stata anche compresa la probabile necessità di trattamenti aggiuntivi – quali l’immunizzazione - per eliminare le cellule infette dopo la riattivazione della latenza. I pazienti messi in terapia nelle primissime fasi dell’infezione acuta presentano il minor carico di cellule latentemente infette e possono essere i migliori candidati per i primi studi sull’eradicazione.
La cura del paziente tedesco suggerisce che la modificazione genetica del CCR5 potrebbe permettere di curare altri pazienti, anche se il contributo di altri elementi connessi al trapianto allogenico deve essere ancora chiarito. L’esperienza della modificazione genetica del CCR5 dei linfociti T autologhi è ancora nelle sue fasi iniziali e non ha ancora dimostrato di poter costituire una cura funzionale. Nuovi approcci come quello di bloccare la PD-1 per migliorare la funzione dei CD8 HIV-specifici sono interessanti, ma richiedono ancora molto studio.
- - K.Collins_Staminali come reservoir, APOBEC3G e altro ancora con il lavoro di Sarah Palmer sul virus nelle staminali;
- Margolis sul SAHA in Trial su HDACi per eradicazione_Lewin/Margolis vs Clements 2;
- Lalezari e June sull'SB-728-T in [STUDI] Sangamo: CD4 e staminali resi CCR5- mediante ZFN II;
- Siliciano su chinoline, disulfiram e tentativo di eliminazione dei reservoir attraverso anche l'azione citolitica dei linfociti T in [STUDI] Siliciano: tre chinoline per riattivare l’HIV;
- Una domanda a Paula Cannon, a seguito del lavoro di Mellors e Cillo in [STUDI]Cannon_trapianto staminali umane rese CCR5- in topi 2.
CROI 2012: HIV Persistence, Latency and Eradication
La terapia antiretrovirale combinata sopprime in modo durevole la replicazione dell’HIV a dei livelli che consentono il miglioramento della funzione immunitaria, la libertà da malattie opportunistiche e aumentano enormemente l’aspettativa di vita. Tuttavia, non cura l’infezione da HIV. Molti pazienti continuano ad avere livelli molto bassi di HIV RNA nel sangue e nel tessuto linfatico. In quasi tutti i pazienti si possono rilevare genomi virali sotto forma di DNA provirale integrato nei linfociti T CD4 memoria, che hanno una lunga vita e che possono produrre HIV dopo che la cellula viene attivata.
Ad oggi, tutti i tentativi di sospendere la HAART, non importa quanto completa fosse la soppressione dell’HIV RNA e quanto a lungo fosse durata la terapia, hanno comportato un rebound virale e un deterioramento immunitario, nel giro di settimane o mesi. L’apparente cura di un singolo paziente (“il paziente tedesco”), che è rimasto libero da virus e senza HAART dopo aver ricevuto un trapianto allogenico di cellule staminali ematopoietiche per il trattamento di [una leucemia], ha stimolato un nuovo interesse a cercare una cura. Alcune ricerche si sono concentrate sulla completa eradicazione dell’HIV, mentre altri approcci aspirano a una cura “funzionale”, cioè uno stato in cui l’HIV rimane rilevabile, ma non si verifica progressione della malattia, anche in assenza di HAART.
Una sessione di abstract orali durante il CROI ha visto la presentazione di studi sulla persistenza, la latenza e l’eradicazione dell’HIV.
Eradicazione dell’HIV. Il trattamento del paziente tedesco è stato unico, perché il donatore delle staminali era omozigote CCR5Delta32, cioè le sue cellule erano prive di un co-recettore che è cruciale per l’ingresso dell’HIV. Non è chiaro se questo sia stato il fattore determinante per il successo della cura o se abbiano contribuito anche altri fattori. Cillo et al, abstr. 154 hanno valutato la presenza dell’HIV in 10 pazienti con linfoma associato all’HIV, che sono stati trattati con trapianto autologo di staminali. 9 pazienti su 10 continuavano ad avere HIV RNA rilevabile nel sangue e tutti avevano HIV DNA rilevabile nelle cellule. Questo studio suggerisce che la chemioterapia mieloablativa aggressiva, quale quella usata nel trapianto autologo, non sia in grado di eradicare l’HIV. Tuttavia, i regimi chemioterapici utilizzati con questi pazienti erano diversi da quello usato nel caso del paziente tedesco. Inoltre, questi pazienti non hanno ricevuto l’irradiazione total body, non hanno avuto Graft vs Host Disease – come invece può accadere nei trapianti allogenici – e sono state loro reinfuse le loro stesse staminali, che è possibile che fossero state contaminate da linfociti T infetti da HIV e che, per di più, non erano prive del recettore CCR5. Pertanto, l’aspetto principale che ha portato all’eradicazione del virus nel caso del paziente tedesco rimane da chiarire.
Quando i CD4 memoria, che ospitano del DNA provirale latente, vengono attivati, l’HIV RNA si esprime e si creano dei virioni. Nei pazienti in cui la HAART funziona, vengono impediti nuovi cicli di infezione. Tuttavia, le cellule che contengono DNA provirale latente non possono essere attivate in modo selettivo. Tentativi fatti in passato di ripulire il reservoir latente attraverso l’attivazione non selettiva dei linfociti T hanno comportato livelli di tossicità non accettabili. Questo ha spinto a cercare nuove strade per indurre l’espressione dell’HIV senza l’attivazione dei linfociti T. I meccanismi cellulari che controllano l’espressione dei geni non sono del tutto compresi, ma le iston-deacetilasi (HDAC) sono un’importante classe di enzimi, che aiutano a mantenere il legame del DNA con gli istoni, impedendo la trascrizione. Si è visto che dei farmaci che inibiscono gli HDAC riescono in vitro a forzare l’espressione genica dell’HIV nei linfociti T latentemente infetti, senza indurre attivazione dei T. Il vorinostat (VOR), chiamato anche SAHA, è un inibitore dell’HDAC approvato per il linfoma cutaneo dei linfociti T. Margolis, abstr. 157LB ha portato i risultati di un piccolo studio pilota (su 6 persone) in cui una singola dose di VOR è stata data a persone HIV+ aviremiche. L’espressione dell’HIV RNA è stata misurata nelle cellule ottenute per leucaferesi prima di somministrare il VOR, 4 ore e 8 ore dopo. L’HIV RNA è stato anche misurato nel plasma usando un single-copy assay molto sensibile. I livelli di espressione dell’HIV RNA nei CD4 quiescenti sono aumentati in modo significativo in tutti e 6 i pazienti dopo somministrazione di VOR, mentre i livelli di RNA nel plasma non sono stati modificati. Non si sono visti effetti avversi dipendenti dal farmaco. Questa è la prima dimostrazione in vivo di distruzione della latenza dell’HIV ed è incoraggiante. Tuttavia, i risultati sono preliminari. I ricercatori non hanno tentato di misurare le variazioni nella dimensione del serbatoio latente, perché si riteneva improbabile che ci fossero dei cambiamenti dopo una sola dose di trattamento. Il VOR è mutagenico nei batteri e nelle cellule dei mammiferi e aumenta il rischio di aborto e di malformazioni negli animali. Non è ancora chiaro se sia possibile arrivare a una riduzione del serbatoio latente o all’eradicazione, né quanto dovrebbe durare la terapia, né se il profilo di sicurezza del VOR permetterà a questa sostanza di essere utilizzata in studi di più lunga durata.
Lo studio sul VOR suggerisce che la distruzione della latenza sia possibile, ma i dati presentati in un altro studio suggeriscono che questa, da sola, possa non essere sufficiente a ridurre il serbatoio latente. Quando i CD4 memoria che contengono DNA provirale latente vengono attivati, essi subiscono un processo di apoptosi e vengono eliminati dal serbatoio latente. Il destino delle cellule che esprimono geni dell’HIV dopo il trattamento con un HDACi non è noto. Shan et al, abstr. 153 hanno isolato dei CD4 quiescenti da persone con HIV e li hanno trattati con VOR. Queste cellule, che sono rimaste nello stato di quiescenza, non sono state uccise dalla semplice riattivazione dell’HIV e sono rimaste vitali in coltura fino a 18 giorni. Quando alle colture dei CD4 latentemente infetti che erano stati trattati con VOR sono stati aggiunti dei CD8 autologhi, si è verificata l’uccisione dei CD4 infetti quando il donatore era un elite controller, cioè un paziente che mantiene i livelli plasmatici di HIV RNA al di sotto del limite di rilevamento senza la HAART. Le cellule degli elite controller avevano una buona attività citotossica dei linfociti T (CTL) spontanea. Invece, i CD8 di 7 su 8 donatori in HAART non avevano questa buona attività CTL e non riuscivano a uccidere i CD4 infetti. La stimolazione in vitro dei CD8 con dei peptidi dell’HIV ha migliorato l’attività CTL e l’uccisione delle cellule infette. Questo studio suggerisce che la distruzione della latenza con sostanze che non inducono attivazione dei linfociti T può non essere in grado di ridurre il reservoir latente. Aggiungere un’immunizzazione che stimoli l’attività CTL può essere necessario per uccidere le cellule infette dopo che si è indotta l’espressione genica dell’HIV.
Per ragioni di potenza, sicurezza e tollerabilità, le sostanze che si sa che interferiscono con la latenza dell’HIV possono non essere l’ideale. Probabilmente serviranno nuove sostanze. Xing et al, abstr. 156 hanno descritto un nuovo test per analizzare e identificare dei composti in grado di agire sulla latenza. Sono state identificate due classi di nuovi composti, che hanno proprietà di farmaci. Questi non inducono secrezione di citochine o attivazione dei linfociti T. Il loro meccanismo di azione non è ancora stato determinato.
L’inizio della HAART a uno stadio molto precoce dell’infezione può ridurre il serbatoio di cellule che ospitano HIV latente. Buzon et al, abstr. 151 hanno misurato periodicamente l’HIV DNA in pazienti da lungo tempo in HAART, che avevano iniziato la terapia in fase acuta (n=9), o cronica (n=26) e in elite controller (n=37). Hanno inoltre valutato il reservoir funzionale, usando un test di riattivazione in vitro. Anche un inizio precocissimo della HAART non ha evitato il formarsi di un reservoir latente. Tuttavia, i pazienti trattati durante la fase acuta avevano livelli di HIV DNA totale e integrato e livelli di riattivazione dell’HIV in vitro simili a quelli degli elite controller e notevolmente più bassi rispetto a quelli dei pazienti entrati in terapia durante la fase cronica.
Un secondo studio, presentato da Perelson et al, abstr. 152, ha utilizzato i dati di 27 pazienti trattati in fase acuta e un modello matematico per identificare delle correlazioni fra la viremia, la dinamica dei linfociti T e la dimensione del reservoir funzionale latente. I loro risultati hanno portato ulteriore sostegno all’idea che un inizio precoce della HAART limiti la dimensione del reservoir latente. Poiché in questi pazienti il serbatoio latente è più piccolo, coloro che iniziano la HAART in fase acuta potrebbero essere i migliori candidati per studi pilota che tentino di eradicare il virus.
Cura funzionale. Al CROI 2011, ci fu grande eccitazione per le relazioni iniziali sul transfer di linfociti T autologhi modificati in modo da renderli CCR5 negativi come terapia per l’HIV. Al congresso di quest’anno, Tebas et al, abstr. 155 hanno portato un aggiornamento di questo studio pilota. I CD4, raccolti mediante leucaferesi, di 21 pazienti con viremia controllata dalla HAART sono stati infettati ex vivo con un adenovirus incapace di replicazione, che ha fatto da vettore per portare una nucleasi a dita di zinco capace di bloccare il gene CCR5. Le cellule sono poi state espanse e re-infuse. Dopo l’infusione, si sono osservati rapidi e consistenti aumenti dei CD4; i pazienti che all’inizio dello studio avevano un maggior numero di CD4 hanno avuto gli incrementi maggiori. Tali incrementi non sono stati dovuti all’espansione delle cellule geneticamente modificate, che sono rimaste rilevabili a livelli medi attorno al 2%. Invece, è la stimolazione con diverse citochine che sembra responsabile dell’espansione dei linfociti T non modificati. Sei pazienti hanno interrotto la terapia per 12 settimane. Tutti hanno avuto rebound virali, seguiti da modesti declini. Uno dei 6 pazienti ha avuto transitoriamente livelli di HIV RNA non rilevabili, subito prima di riprendere la HAART. Quel paziente era eterozigote Delta 32 e presentava una proporzione di alleli CCR5 anomali molto più alta rispetto agli altri. Non ci sono stati dei controlli, quali per esempio pazienti trattati con infusioni di CD4 non modificati o senza infusioni, quindi è difficile capire se gli schemi osservati siano da attribuirsi alle cellule modificate. L’obiettivo di questo trattamento è una cura funzionale, grazie all’instaurarsi di uno stato chimerico con sia CD4 infetti, sia CD4 modificati geneticamente in modo da renderli resistenti all’HIV. Queste cellule resistenti potrebbero, in teoria, formare la base per una efficace risposta immune HIV-specifica, capace di controllare l’infezione da HIV nelle cellule non modificate; ma i dati sull’evoluzione di risposte immuni HIV-specifiche non sono stati presentati.
Le risposte immuni più efficaci contro l’HIV si sono viste associate con più bassi livelli di HIV RNA, più bassi livelli di attivazione immunitaria generalizzata, mantenimento di un numero normale di CD4 e non progressione della malattia. I componenti necessari per un’efficace risposta immunitaria non sono del tutto compresi, ma si è identificato di frequente, fra questi, il controllo virale grazie ai linfociti T CD8+. Queste risposte, in genere, sono basse o assenti in pazienti in cui l’infezione è a uno stadio avanzato. I CD8 inefficaci esprimono il marker di superficie PD-1, un sotto-regolatore delle risposte immuni e un segnale di esaurimento dei linfociti T. Velu et al, abstr. 158LB hanno indagato il potenziale terapeutico del blocco della PD-1 mediante una serie di infusioni di un anticorpo monoclonale anti-PD-1 in un modello di macachi infetti da SIV. In alcuni animali trattati, si è visto un miglioramento dell’attività anti-HIV dei CD8, con corrispondente declino nelle viremie, che non si è osservato nei controlli, che non erano stati trattati. Tuttavia, gli animali studiati erano pochissimi e non sono state fatte analisi statistiche, il che rende prematura ogni conclusione sull’attività di una terapia con anticorpi anti-PD-1.
Sintesi. David Ho e altri avevano previsto che l’HIV avrebbe potuto essere eradicato più o meno dopo 7 anni di HAART, e le prime stime sull’emivita del reservoir latente facevano pensare che questo sarebbe infine decaduto. Questa teoria era diffusa agli inizi dell’epoca della HAART. Ci furono degli studi fatti al NIAID e altrove che non riuscirono a rilevare HIV DNA nelle PBMC in alcuni pazienti dopo anni di HAART, quindi le terapie furono sospese; ma tutti ebbero un rebound. Ci sono voluti parecchi anni prima che prendesse piede la convinzione che la HAART da sola non avrebbe eradicato il virus. Dopo che vennero meno le speranze iniziali che un periodo prolungato di HAART da sola avrebbe infine eradicato l’HIV, la cura parve una possibilità davvero remota. La possibilità sia di eradicare, sia di giungere a una cura funzionale, è ancora abbastanza lontana, ma ora si riesce a discernere una via verso questi obiettivi. È stato trovato un farmaco capace di interrompere la latenza dell’HIV senza attivare i linfociti T, così come sono stati trovati degli strumenti per identificare nuove sostanze che agiscano meglio e siano più sicure. È stata anche compresa la probabile necessità di trattamenti aggiuntivi – quali l’immunizzazione - per eliminare le cellule infette dopo la riattivazione della latenza. I pazienti messi in terapia nelle primissime fasi dell’infezione acuta presentano il minor carico di cellule latentemente infette e possono essere i migliori candidati per i primi studi sull’eradicazione.
La cura del paziente tedesco suggerisce che la modificazione genetica del CCR5 potrebbe permettere di curare altri pazienti, anche se il contributo di altri elementi connessi al trapianto allogenico deve essere ancora chiarito. L’esperienza della modificazione genetica del CCR5 dei linfociti T autologhi è ancora nelle sue fasi iniziali e non ha ancora dimostrato di poter costituire una cura funzionale. Nuovi approcci come quello di bloccare la PD-1 per migliorare la funzione dei CD8 HIV-specifici sono interessanti, ma richiedono ancora molto studio.