Animal Models of HIV Prevention and Cure

La lezione si divide in due parti: nella prima vengono trattati i modelli animali (topi umanizzati e primati non umani) sviluppati per la prevenzione dell’HIV, nella seconda i modelli animali che si usano per la ricerca di una cura.
Dopo un ringraziamento a Victor Garcia, uno dei padri del modello dei topi umanizzati, Silvestri ricorda che nella ricerca su HIV/AIDS si usano soprattutto scimmie asiatiche, che allo stato selvatico non vengono infettate da lentivirus, ma se vengono infettate con SIV sviluppano AIDS. Si usano anche scimmie africane e queste sono infette da SIV in natura e sono considerate gli ospiti naturali di SIV, perché non sviluppano la malattia. Ci sono infine scimmie dal Nuovo Mondo, che sono intrinsecamente resistenti all’infezione da SIV.
Fra i benefici dei modelli di primati non umani, Silvestri elenca
- - la stretta relazione filogenetica fra uomini e scimmie;
- l’infezione da HIV negli uomini e quella da SIV o SHIV nelle scimmie presenta somiglianze impressionanti secondo moltissimi punti di vista;
- la caratterizzazione genetica e immunologica dei macachi ha fatto recentemente dei grandi passi avanti;
- usando questo modello animale – definito da Picker e Douek come “il miglior modello animale per qualsiasi malattia umana” – si sono avuti dei successi straordinari nello studio della trasmissione, della patogenesi, della prevenzione e della terapia di HIV.
Fra i possibili problemi,
- - gli studi sui primati non umani sono costosi e condurre degli studi su un numero di animali sufficiente ad ottenere risultati significativi richiede investimenti economici considerevoli;
- poiché le risorse per l’uso di macachi con infezione da SIV o SHIV e trattati con ART non sono centralizzate e non esistono coorti di questi animali, nelle ricerche per arrivare a una cura/eradicazione dell’HIV, ciascun gruppo di lavoro deve crearsi le proprie risorse, infettando gli animali e mettendoli in terapia e testando gli interventi progettati per la cura;
- esistono comunque differenze fra scimmie e uomini, così come fra SIV e HIV.
Quanto ai topi, esistono diversi modelli di topi umanizzati, in ciascuno dei quali ai topi viene trapiantato un sistema ematolinfoide umano (con linfociti, monociti, granulociti, piastrine, globuli rossi, etc.). Questo consente di indagare in vivo quello che l’HIV fa alle cellule umane .
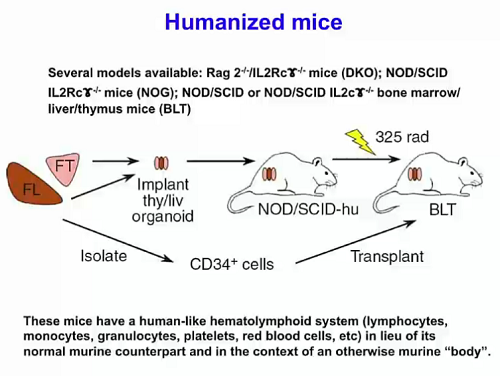
Fra i benefici di questo modello, Silvestri elenca
- - il fatto che sia semplice e relativamente poco costoso (meno costoso di altri modelli, con minori costi di mantenimento e con la necessità di spazi più contenuti);
- può mutare da un punto di vista genetico (se ne può modificare il contesto genetico in cui gli studi vengono condotti);
- se ne può controllare la variabilità intra-genetica e inter-genetica (si possono fare esperimenti con gli stessi o con diversi donatori umani e questo consente di controllare aspetti specifici della genetica umana);
- soprattutto, consente di fare ricerca in vivo usando un virus umano nel contesto di cellule umane.
I problemi, invece, vengono dal fatto che
- - a differenza che in altri modelli basati su piccoli animali, i topi umanizzati non possono riprodursi, quindi è impossibile creare delle ampie coorti a partire da un singolo donatore umano;
- la struttura e la funzionalità delle cellule della linea linfoide non sono del tutto normali, quindi valutare le risposte immuni indotte da immunogeni non è facile;
- l’interazione fra le cellule ematolinfoidi di origine umana e le altre cellule del topo può essere subottimale e talvolta anche un poco fuorviante rispetto a quanto accade nella vita reale.
Dopo aver descritto i pro e i contra dei modelli, Silvestri passa a descrivere mediante degli esempi alcuni possibili usi dei modelli animali nella prevenzione dell’infezione.
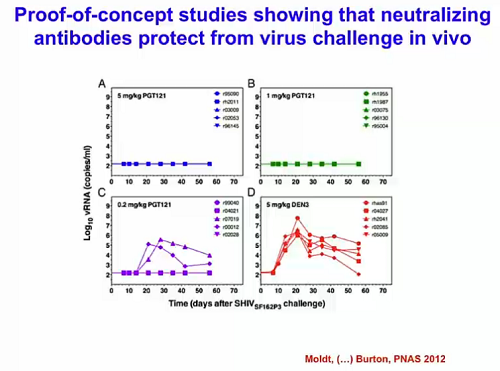
Degli studi per la prevenzione dell’HIV sono stati, ad esempio, il transfer passivo di anticorpi neutralizzanti, che si è visto proteggere dei macachi rhesus dal tentativo di infettarli con SHIV. Questo ha dunque fornito la proof of concept che gli anticorpi neutralizzanti hanno il potere di proteggere dalla trasmissione dell’HIV.
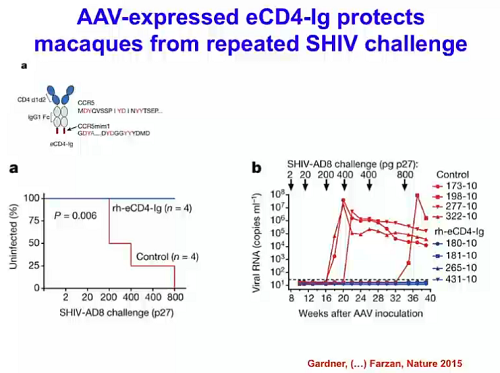
Un altro è lo studio molto più recente, fatto da Michael Farzan e il suo gruppo allo Scripps, in cui si è dimostrato che è possibile impedire la trasmissione di SHIV usando un complesso formato da un anticorpo non del tutto naturale e un adenovirus che, a differenza della somministrazione passiva di anticorpi il cui effetto dura pochi giorni o settimane, è un vettore persistente che esprime alti livelli della proteina e dunque conferisce protezione per periodi più lunghi.
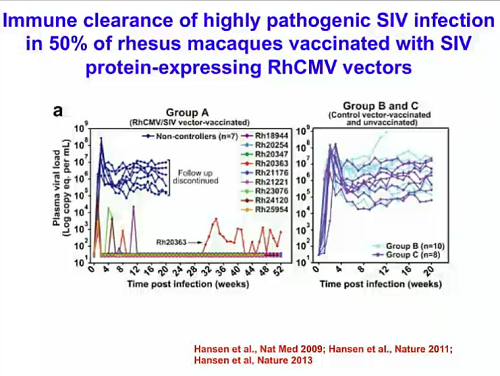
Silvestri presenta poi lo studio di Picker sul ruolo della particolare risposta cellulare contro il virus indotta dal citomegalovirus usato come vettore, che ha consentito protezione o eradicazione del virus in un modello di macachi infettati con SIV.
Infine, Silvestri parla dello studio pubblicato da Markowitz poche settimane fa sulla capacità di un nuovo inibitore dell’integrasi a lungo rilascio (il cabotegravir) nel proteggere fino a 7 settimane dei macachi femmina dalla trasmissione di SHIV per via vaginale. Questo farmaco potrebbe costituire un nuovo paradigma per la PrEP.

Passando ai topi, Silvestri ricorda un lavoro di Bradley uscito l’anno scorso, in cui a dei topi transgenici sono stati trapiantati dei geni umani in grado di generare anticorpi ampiamente neutralizzanti contro l’HIV.
Infine i modelli animali negli studi sulla cura.
Le opportunità offerte dai modelli con primati non umani sono tali da poterci davvero insegnare che cosa serve per arrivare a curare l’infezione:
- - in questi modelli animali si possono fare degli studi molto ben controllati, perché è possibile modificare e controllare la variabilità di parametri clinici di fondamentale importanza quali il tempo e la modalità dell’infezione, la durata della terapia, etc., che sono invece impossibili da controllare nel caso degli esseri umani;
- è possibile inoltre caratterizzare in modo esauriente i reservoir cellulari e anatomici, sia quelli attivi, sia quelli latenti, ed è possibile indagarli anche mediante necropsie selettive – in una situazione come quella umana, in cui non sappiamo esattamente dove si localizzino i reservoir e che cosa accada nei diversi organi e comparti anatomici, gli studi sulle scimmie offrono delle informazioni irrinunciabili;
- nei modelli di scimmie si possono condurre studi pilota sull’eradicazione, soprattutto strategie che prevendono la combinazione di più farmaci, in modo molto più aggressivo e controllato che sugli uomini; inoltre non ci sono preclusioni alle interruzioni terapeutiche;
- si possono poi fare interventi – dalle combinazioni terapeutiche agli studi sulla deplezione cellulare, ai trapianti di staminali, etc. – che permettono di comprendere i meccanismi attraverso i quali si formano e si mantengono i reservoir.
Le vere limitazioni incontrate da questi studi sono, come già detto, i costi e l’assenza di risorse standardizzate.
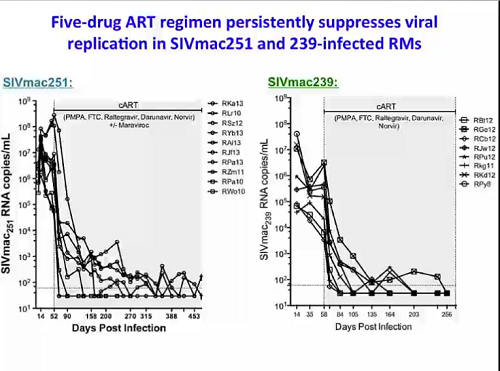
Fra gli esempi di studi su scimmie, Silvestri mostra una ricerca che sta conducendo lui stesso e Mirko Paiardini nel suo laboratorio alla Emory University su un modello di soppressione virologica persistente mediante un regime di 5 antiretrovirali in scimmie infettate o con SIVmac251, o con SIVmac239. La base da cui partire per testare qualsiasi strategia contro i reservoir.
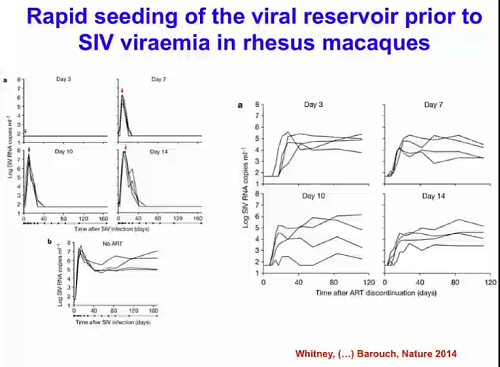
Il lavoro successivo citato da Silvestri è quello con cui Barouch l’anno scorso ha dimostrato la formazione di reservoir latenti nei macachi prima ancora che l’SIV RNA sia rilevabile nel sangue.
La terapia iniziata a 3, 7, 10 o 14 giorni dopo l’infezione ha dimostrato come anche soltanto 3 giorni dopo l’infezione si è formato un reservoir tale per cui, se si interrompe la ART, si osserva un rapido rebound della viremia. Questo studio proof of concept è stato molto importante, perché ha spiegato per esempio il ritorno del virus nel caso della Mississippi Baby e dà delle indicazioni molto chiare su che cosa aspettarsi quando si inizia la ART anche in fasi molto precoci dell’infezione.
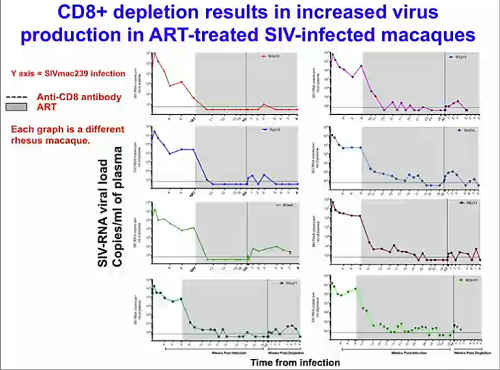
Silvestri mostra poi una slide che illustra una ricerca in corso nel suo laboratorio, in cui si sta dando dimostrazione a un’idea nuova e ancora non provata secondo cui, se si distruggono mediante un anticorpo i CD8 in scimmie infette da SIV e con viremia soppressa dalla ART, si causa un aumento nella produzione virale in quasi tutti gli animali. Questo ci dice che perché la ART sopprima completamente non tanto la replicazione, quanto la produzione del virus, bisogna che ci siano i CD8. Una dimostrazione del ruolo che i CD8 devono avere in una strategia di eradicazione dell’HIV.
La lezione si rivolge poi a due studi –uno di Hans Peter Kiem e uno di Silvestri stesso – in cui si è dimostrata la possibilità di condurre nei primati non umani studi come il trapianto di staminali e la terapia genica che già si fanno sugli uomini, ma con un approccio più aggressivo, che porta a risultati più chiari.

L’uso dei modelli murini negli studi di eradicazione è un campo che si sta evolvendo di recente e in cui Silvestri sta ora collaborando con Victor Garcia. Gli aspetti più rilevanti, che rendono possibile l’uso di questi modelli per rispondere a domande specifiche sull’eradicazione, sono
- - il fatto che la ART riesce ad indurre una soppressione molto efficace dell’HIV nei topi umanizzati (BLT – bone marrow, liver, thymus);
- l’HIV va in latenza nei CD4 umani nei topi BLT;
- la trascrizione dell’HIV latente può essere indotta ex vivo dopo l’attivazione dei CD4 umani latentemente infetti;
- durante la ART, i CD4 umani latentemente infetti si distribuiscono in tutti i tessuti dei topi BLT, così riproducendo la distribuzione dei reservoir nell’uomo.
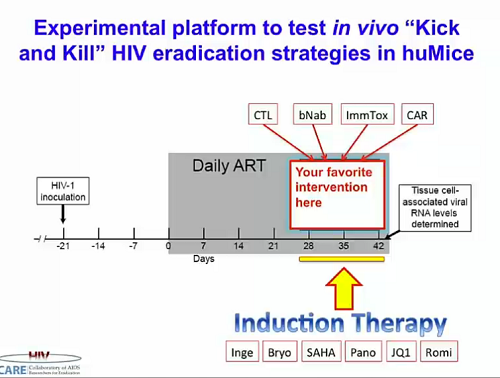
Silvestri mostra poi una tipica piattaforma sperimentale usata per testare in vivo interventi di tipo “kick and kill” nei topi umanizzati: una sostanza antilatenza per riattivare il virus nelle cellule latentemente infette e un qualche tipo di intervento immune per eliminare quelle cellule una volta che il virus è stato riattivato.
Grazie al costo minore di questi modelli rispetto a quelli con scimmie, gli studi “shock and kill” beneficeranno della ricerca sui topi, soprattutto per la possibilità di testare combinazioni multiple di farmaci.
Silvestri conclude la sua presentazione elencando tre questioni che riassumono l’uso degli animali nella ricerca contemporanea su HIV/AIDS:
- 1. gli scienziati che lavorano sui modelli di topi umanizzati e quelli che lavorano sui modelli di scimmie dovrebbero interagire di più per poter indagare più a fondo le proprietà complementari e le possibili sinergie di questi due modelli;
2. questi modelli non sono perfetti, quindi è necessario continuare ad ottimizzare entrambi a livello della caratterizzazione genetica, dei test virologici e immunologici, dello sviluppo di reagenti, etc. mentre, al tempo stesso, si continua ad usarli in studi di alto profilo;
3. è necessario centralizzare le risorse relative ai macachi infetti da SIV/SHIV e trattati con ART in modo che i diversi gruppi di lavoro possano avere una coorte omogenea da utilizzare per testare nuovi approcci alla cura.