FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
Mariuccio, e di che ti vergogni? per favore, archivia queste cose, ognuno ha la sua storia e la strada che ci ha portati qui è stata segnata per tutti da incidenti ed errori. Abbi fiducia, Dora ci ha dato più di una buona notizia, vedrai.
Un abbraccio!
Inviato utilizzando Tapatalk
Un abbraccio!
Inviato utilizzando Tapatalk
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
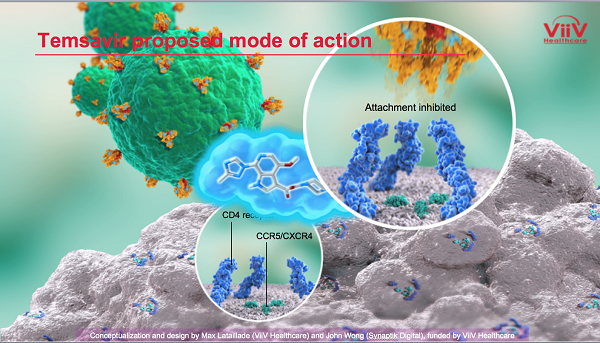
IAS 2019 - FOSTEMSAVIR IN PAZIENTI MOLTO TRATTATI: RISULTATI FASE III
ViiV Healthcare ha presentato ieri al congresso IAS di Città del Messico i risultati dello studio BRIGHTE sul fostemsavir, una sperimentazione randomizzata di fase III su pazienti già prima molto trattati e con infezioni multiresistenti.
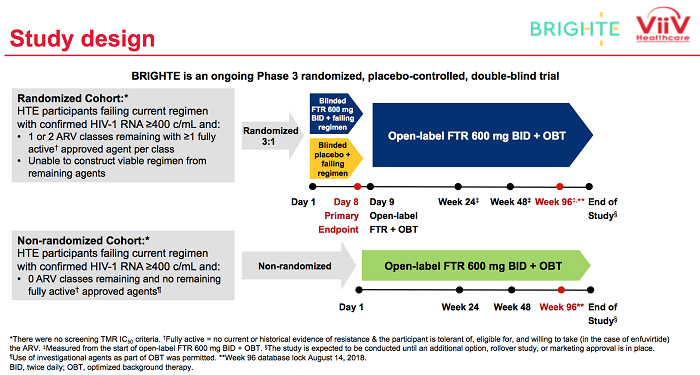
I risultati sono stati buoni e gli endopoint sono stati raggiunti, perché questo inibitore dell'aggancio, in combinazione con un trattamento di background ottimizzato sulla base delle resistenze dei singoli partecipanti, ha permesso di continuare a mantenere la soppressione virologica dalla 24° alla 48° settimana.
Essendo un antiretrovirale di una classe totalmente nuova, che si basa su un meccanismo d'azione mai prima utilizzato, non si sono mai viste in vitro delle resistenze crociate con altre classi di ARV e questa è la ragione per cui lo si sta sperimentando su persone con infezioni multiresistenti.
Il 54% dei pazienti nella coorte che è stata randomizzata per ricevere il fostemsavir (cioè 146 su 272) dopo 48 settimane manteneva viremia sotto le 40 copie. In questa coorte si è anche potuto misurare un miglioramento dei valori immunologici, con un aumento medio dei CD4 di 139 cellule/mL.
Chi di partenza aveva alti livelli di HIV RNA (>100.000 copie/mL) e bassi CD4 (<200) ha avuto tassi più bassi di risposta virologica.
Chi partiva da CD4 bassissimi (<20) ha visto miglioramenti dei livelli di CD4 paragonabili a quelli di chi partiva da una situazione immunologica migliore.
Nell'estensione dello studio a 96 settimane, si è osservato un continuo miglioramento e la soppressione virologica è stata mantenuta nel 60% dei partecipanti.
Nella maggior parte delle persone che hanno ricevuto il farmaco si è avuto almeno un evento avverso (soprattutto diarrea, nausea e mal di testa). Gli eventi avversi più gravi, che si sono verificati nel 3% dei partecipanti, hanno colpito le pesone in situazione immunitaria più compromessa. Il 7% dei partecipanti ha abbandonato lo studio a causa di qualche evento avverso.
Una analisi condotta in un sottoguppo di partecipanti ha mostrato un'alta risposta virologica in pazienti con più di 50 anni, donne o che riferivano di sé di essere neri o afro-americani.
La richiesta di approvazione alla FDA è prevista entro quest'anno.
Fonti:
- Week 96 safety and efficacy of the novel HIV-1 attachment inhibitor prodrug fostemsavir in heavily treatment-experienced participants infected with multi-drug resistant HIV-1 (BRIGHTE study)
A subgroup analysis of the week 96 efficacy and safety results evaluating fostemsavir in heavily treatment-experienced HIV-1 infected participants in the phase 3 BRIGHTE study: Results from the randomized cohort
Slide complete e il report di Mark Mascolini a breve pubblicati nella pagina di Natap dedicata a IAS 2019
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
E infatti, eccola qui:
sulla base dei risultati del trial di fase III BRIGHTE, presentati l'estate scorsa al congresso della IAS a Mexico City e sintetizzati nel post precedente,
ViiV Healthcare submits New Drug Application to the FDA for fostemsavir, an investigational, first-in-class attachment inhibitor for the treatment of HIV in adults with few treatment options available.
Tutti i dettagli nel comunicato stampa.Fostemsavir è sviluppato per essere usato in combinazione con altri antiretrovirali in adulti che hanno già ricevuto molti trattamenti, che hanno un'infezione da HIV-1 multiresistente e che non riescono a impostare un regime che sopprima la viremia a causa di resistenze, intolleranze o problemi di sicurezza.
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
E arriva ora anche la richiesta di approvazione all'EMA, il cui Committee for Medicinal Products for Human Use (CHMP) ha garantito un procedimento rapido.
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
Ieri la FDA ha approvato il fostemsavir (nome commerciale Rukobia) per trattare l'infezione da HIV in persone con poche opzioni terapeutiche a disposizione.
È il primo antiretrovirale della nuova classe degli inibitori dell'aggancio.
Comunicato stampa: ViiV Healthcare Announces US FDA Approval for Rukobia (fostemsavir), a First-in-Class Treatment for HIV in Adults With Few Treatment Options Available
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
Dora ha scritto: ↑venerdì 3 luglio 2020, 5:18
Ieri la FDA ha approvato il fostemsavir (nome commerciale Rukobia) per trattare l'infezione da HIV in persone con poche opzioni terapeutiche a disposizione.
È il primo antiretrovirale della nuova classe degli inibitori dell'aggancio.
Comunicato stampa: ViiV Healthcare Announces US FDA Approval for Rukobia (fostemsavir), a First-in-Class Treatment for HIV in Adults With Few Treatment Options Available
Parere positivo del Committee for Medicinal Products for Human Use (CHMP) dell'EMA all'approvazione di Rukobia (fostemsavir).
L'approvazione europea è prevista nei prossimi mesi.
Re: FOSTEMSAVIR (GSK3684934): inibitore dell'aggancio
Dora ha scritto: ↑sabato 12 dicembre 2020, 6:19Dora ha scritto: ↑venerdì 3 luglio 2020, 5:18
Ieri la FDA ha approvato il fostemsavir (nome commerciale Rukobia) per trattare l'infezione da HIV in persone con poche opzioni terapeutiche a disposizione.
È il primo antiretrovirale della nuova classe degli inibitori dell'aggancio.
Comunicato stampa: ViiV Healthcare Announces US FDA Approval for Rukobia (fostemsavir), a First-in-Class Treatment for HIV in Adults With Few Treatment Options Available
Parere positivo del Committee for Medicinal Products for Human Use (CHMP) dell'EMA all'approvazione di Rukobia (fostemsavir).
L'approvazione europea è prevista nei prossimi mesi.
L'EMA ha approvato la commercializzazione del fostemsavir (Rukobia).