Considerazioni di una disfattista ignorante (da mettere subito al rogo, al rogo!)
Considerazioni di una disfattista ignorante (da mettere subito al rogo, al rogo!)
Quando i Torquemada del metodo scientifico, quelli sempre pronti ad affibbiare
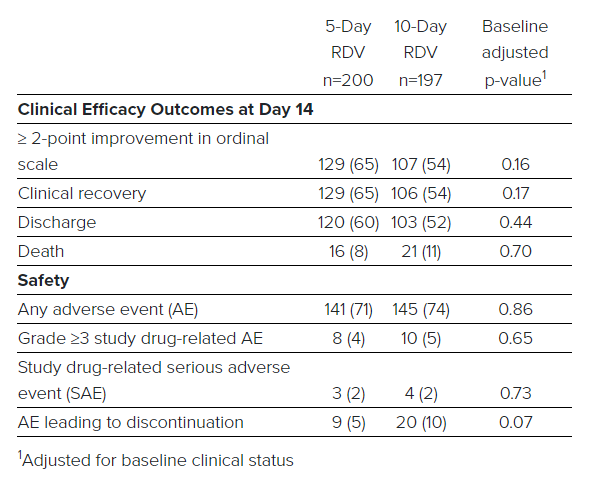
patenti autocertificazioni di scientificità e condanne per ciarlataneria, quelli per cui Raoult è un delinquente e Fauci invece un santo, gioiscono per il remdesivir - che, come previsto, ha ricevuto ieri
dall'FDA una Emergency Use Authorization - esattamente perché lo fanno?
Per
il pre-print degli NIH sulle 6 scimmie, in cui i macachi con un'infezione non grave -
come da modello - hanno ricevuto una sorta di profilassi post esposizione impossibile da replicarsi nell'uomo con un farmaco che deve essere somministrato in ospedale, in cui si è scelto di intervenire
prima che i livelli di viremia nei polmoni diventassero troppo alti e ciò nonostante la viremia è sempre rimasta presente nelle vie aeree superiori, in cui
con un artificio furbetto sono stati sovrastimati i dati preparando il terreno per future spiacevoli sorprese nella forma di mancate replicazioni?
O per l'articolo di Gilead sul
New England Journal of Medicine, in cui l'uso
compassionevole del farmaco su un piccolo numero di persone, senza gruppo di controllo e con una serie interminabile di bias ha dato luogo a
risultati abbastanza pietosi?
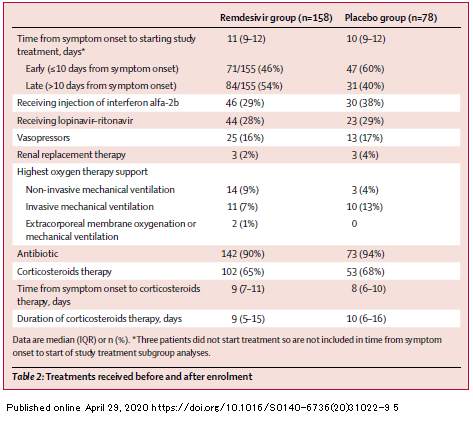
Oppure gioiscono perché, nella guerra di Fauci contro Trump, il remdesivir si è guadagnato l'approvazione di emergenza e lo status di standard of care, che lo mette al riparo da future sperimentazioni con placebo, sulla base di leak, pettegolezzi, comunicati stampa, dichiarazioni di Fauci alla stampa seduto su un divanetto alla Casa Bianca, in totale assenza di articoli peer reviewed, ma con modifica delle dimensioni dei campioni e degli endpoint a trial quasi conclusi, scale di valutazione degli endpoint che lasciano enormi varchi all'arbitrarietà nell'interpretazione, differenze nella mortalità che non sono statisticamente significative neppure nelle dichiarazioni, risultati di un trial randomizzato cinese che
dicono il contrario di quello che Gilead vuole sentire, messi a tacere per la gioia degli azionisti Gilead proprio nel giorno in cui vengono pubblicati su
Lancet ... e in tutto questo, l'unica volta in cui si vedono delle viremie nell'uomo, una desolante indistinguibilità dal placebo?
Quelli che vedono in questa sorta di nuovo Tamiflu una ragione di ottimismo per cui iniziare la giornata con uno spirito da
spezzeremo le reni al coronavirus e chi non è contento è un disfattista con cui faremo i conti a guerra finita (e cara grazia che non pretendono un plotone di esecuzione qui, sui due piedi) verranno ancora a dare lezioni a ditino alzato su che cosa è Scienza e che cosa pseudoscienza?
Con questi effetti sulle viremie di un virus che, se non ti ammazza, si eradica da solo?!

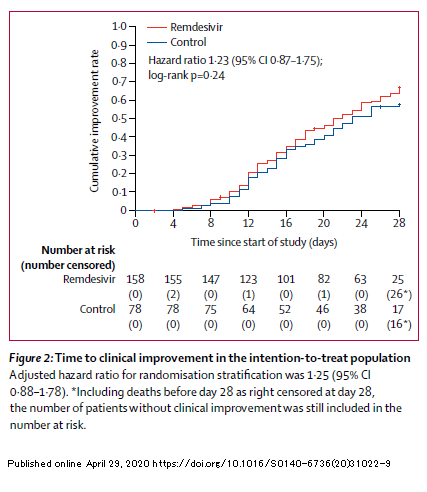
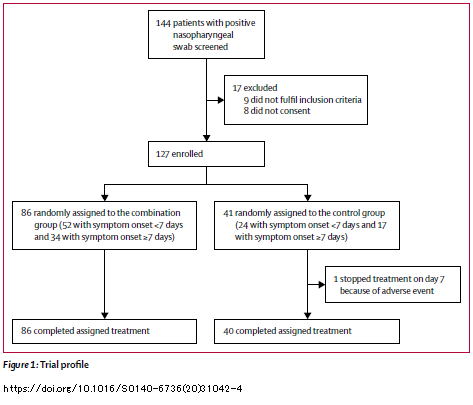
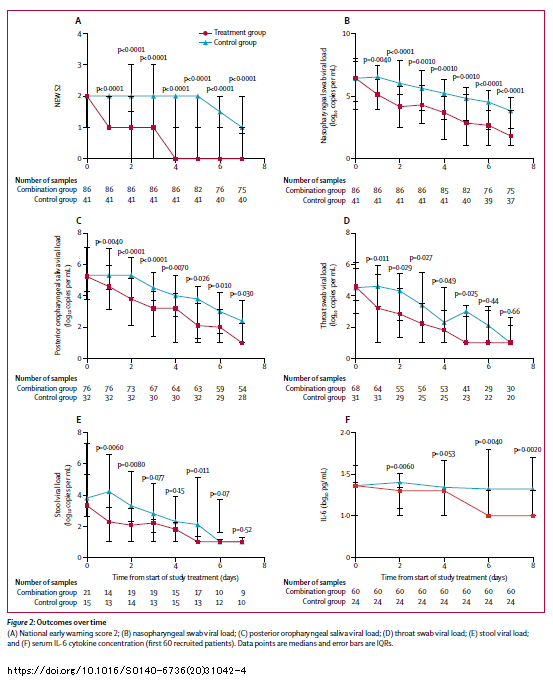
Dal momento che,
come ho scritto l'altro giorno, non ho mai studiato le dinamiche delle viremie di virus respiratori e mi ha però molto colpito l'andamento delle viremie nelle persone dello studio cinese trattate con remdesivir, così sovrapponibile a quello del placebo, ho provato a confrontare quelle tristissime figure del lavoro su
Lancet con un modello che stima l'effetto dell'idrossiclorochina sull'RNA del SARS-CoV-2 che si trova in un articolo messo online su MedRxiv da Savarino pochi giorni fa - ricordo che è un pre-print e non è dunque ancora stato pubblicato:
Pharmacokinetic bases of the hydroxychloroquine response in COVID-19: implications for therapy and prevention
Ricordo anche che, mentre il remdesivir è un antivirale, quindi il suo primo obiettivo è bloccare la replicazione del virus e cioè far calare il livello della viremia il più rapidamente possibile, la clorochina esercita effetti antivirali solo come risultato secondario, perché agisce principalmente sullo stato infiammatorio e sulle risposte cellulo-mediate contro le cellule infettate da SARS-CoV-2. Savarino usa un modello per simulare l'interazione fra virus e ospite e le possibili risposte alla somministrazione di clorochina/idrossiclorochina e poi li compara ai risultati che emergono dalle sperimentazioni cliniche.
Senza tediare nessuno con i dettagli tecnici, che ciascuno può andarsi a vedere direttamente nel paper, l'impatto della clorochina sull'ampiezza della viremia è profondo solo se la viremia non è troppo alta, su viremie corrispondenti a decine e non centinaia di migliaia di copie di RNA/mL. Si tratta comunque di viremie tipicamente rilevate dai tamponi nelle fasi non troppo avanzate dell'infezione.
Come sempre nel caso di infezioni virali, gli interventi sulle viremie sono più efficaci quando sono tempestivi.
Quanto può essere tempestivo il trattamento con un farmaco che si somministra per infusione in ospedale?
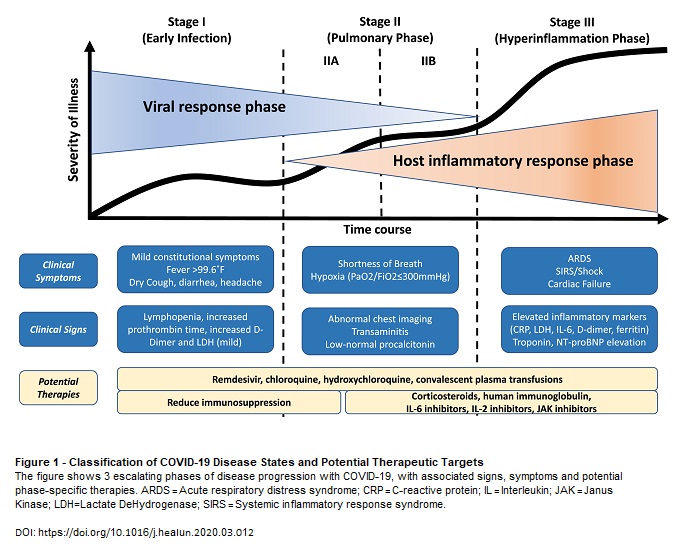
Per capire la necessità di trattare il più in fretta possibile le persone con COVID-19, trovo molto utile questo schema, tratto da
un articolo di ricercatori di Harvard sul
Journal of Heart and Lung Transplantation in cui si propone una stadiazione dell'infezione da SARS-CoV-2 e dei possibili interventi terapeutici:
E adesso andiamo tutti a festeggiare, ché con il remdesivir siamo in una botte di ferro.