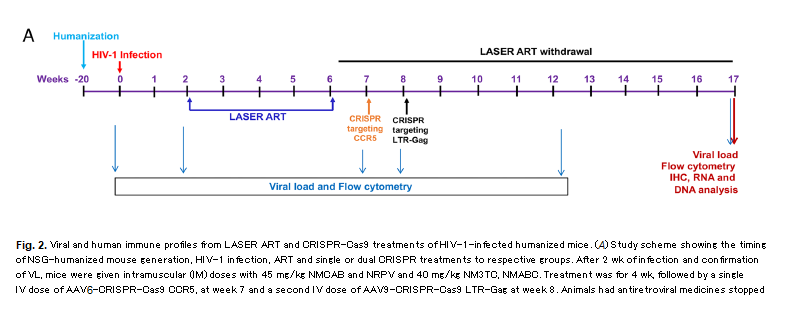
 LASER-ART, CRISPR e un successo al 60% nell'eradicare l'HIV da topi umanizzati
LASER-ART, CRISPR e un successo al 60% nell'eradicare l'HIV da topi umanizzati
Il I maggio sui
Proceedings of the National Academy of Sciences (PNAS), Kamel Khalili ha pubblicato un secondo lavoro di collaborazione con Howard Gendelman su cART a rilascio prolungato e terapia genica mediante CRISPR dopo
quello del 2019 su
Nature Communications:
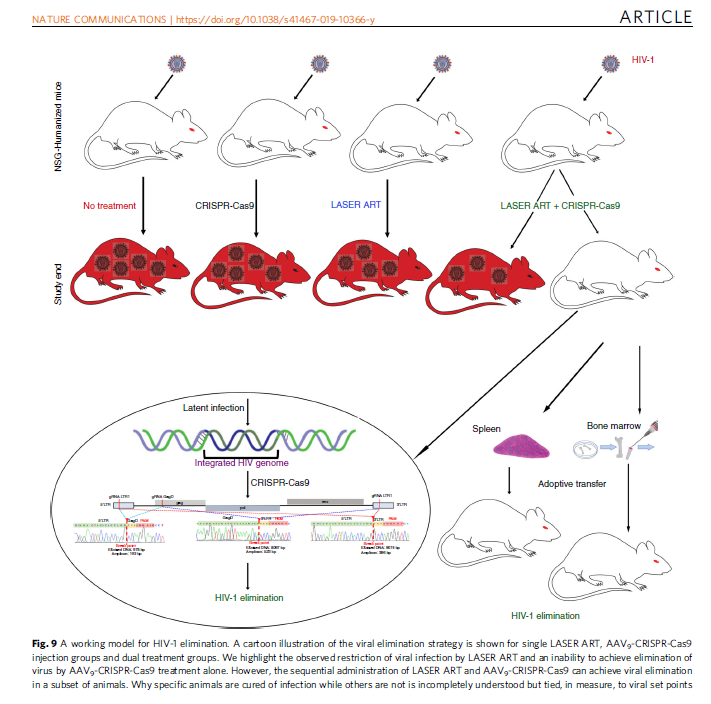
CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice.
La principale novità di questo secondo lavoro, quella che presumibilmente ha consentito di vedere un più consistente successo nell'eradicazione del virus dai topi, è un raddoppiamento dell'approccio con CRISPR: non più un solo RNA guida diretto contro il gene Gag dell'HIV integrato nel genoma dei CD4 latentemente infetti, ma
due gRNA trasportati da AAV
6 - uno sempre contro il gene virale, l'altro contro il gene
ccr5, che permette l'espressione del co-recettore CCR5 sulla membrana dei CD4, seconda "porta d'accesso" per il virus all'interno della cellula.
La
LASER-ART [long-acting slow-effective release (LASER) antiretroviral therapy (ART)] è stata sviluppata nel laboratorio di Gendelman presso la University of Nebraska specificamente per questo modello di topi umanizzati (CD34-NSG), si compone di cabotegravir, lamivudina, e abacavir in combinazione con rilpivirina, e permette di mantenere a lungo basse viremie con poche somministrazioni dei farmaci.
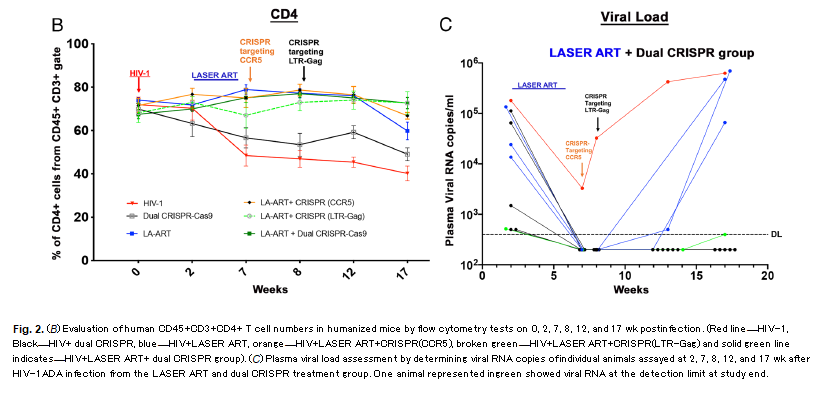
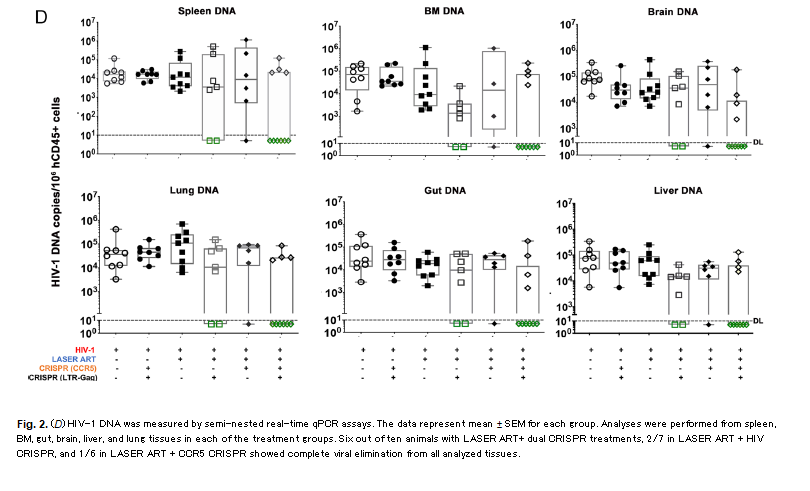
Mentre solo la LASER-ART e solo le CRISPR (da sole o in combinazione) non hanno permesso di eradicare il virus nei diversi gruppi di controllo di questi esperimenti, quando il protocollo della sperimentazione è stato completo e questo complesso regime di antiretrovirali è stato seguito dall'intervento delle dual-CRISPR in topi stabilmente infettati da un virus altamente patogenico e CCR5-tropico, si è assistito prima alla soppressione della viremia, poi al ritorno alla normalità del numero dei CD4, e infine all'eliminazione di virus capace di replicazione in quasi il 60% dei topi (11 su 19).
Né nel sangue né nei tessuti (dal cervello ai linfonodi nell'intestino, nella milza o nel fegato) si sono trovate cellule contenenti virus infettivo.
Il follow up non è stato lunghissimo, 11 settimane (ma pur sempre di topi si tratta), ma sufficiente per non osservare alcun rebound delle viremie nei topi curati.
Quando poi si sono prelevati CD4 dai topi trattati e si è tentato di infettare topi HIV negativi, nessun topo si è infettato, a conferma che il reservoir di HIV capace di riattivarsi e di ricominciare a replicarsi era stato eliminato.
Non sono state osservate tossicità, né è stato possibile rilevare alcun effetto off target.
Per il 40% dei topi che non hanno visto la scomparsa del virus si ipotizza che il vettore AAV
6 che portava le dual CRISPR non sia arrivato proprio in tutti i tessuti dove doveva arrivare.
La conclusione di Khalili, Gendelman e colleghi è che l'editing genetico mediante CRISPR che colpisca sia il CCR5 dell'ospite, sia l'LTR-Gag del virus mentre la replicazione virale è ben controllata dalla cART può portare all'eliminazione dei reservoir di HIV sia nel sangue, sia, soprattutto, nei tessuti.
Gli autori vedono nei loro risultati un potenziale di passaggio agli studi clinici, ma i topi umanizzati non sono proprio il massimo, come modello di eradicazione di HIV, quindi tra i co-autori del lavoro sui
PNAS troviamo anche Trisha Burdo, anche lei alla Katz School of Medicine della Temple University come Khalili, grande esperta di modelli di primati non-umani e dell'uso di CRISPR per la rimozione del DNA di SIV dalle cellule delle scimmie.
A lei spetterà sperimentare queste dual CRISPR nelle scimmie.
Speriamo il più presto possibile.