
HIV Cure Research
Mellors esordisce con quelle che saranno le conclusioni della sua lezione: la barra per ottenere una cura dell’infezione è posta molto in alto e lo è, in particolare, se l’obiettivo che ci poniamo è la completa eradicazione del virus da tutte le persone con l’infezione.

Se abbassiamo un poco l’asticella, si delineano una serie di cure possibili in base alle popolazioni considerate (per esempio i bambini).
Dobbiamo tener conto del fatto che le nostre conoscenze presentano ancora importanti lacune (per esempio sulla localizzazione dei reservoir). Tuttavia, abbiamo a disposizione diversi approcci da sperimentare.
E agli scettici che ritengono irrealistico che a una cura per tutti si possa arrivare Mellors ricorda che solo 20 anni fa l’idea di poter trattare l’infezione con 1 pillola al giorno era fantasia pura.
Le due ragioni principali per cui arrivare a una cura è necessario sono le tossicità e i costi dei farmaci e il perpetuarsi della trasmissione del virus.
Fra il 1997 e il 2009 si riteneva che una cura non fosse possibile e quelli indicati nella slide che segue sono i tre lavori che – più di ogni altro – sembravano sancire questa impossibilità:

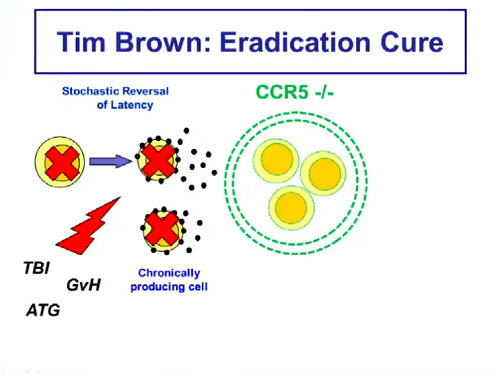
Ma una grandissima ispirazione e un nuovo stimolo è arrivato alla ricerca da parte di Timothy Brown. In breve, la sua storia raccontata da un paio di slides
In questa diapositiva sono indicati i lavori che verranno discussi durante il congresso su diverse ricerche (fallite, come abbiamo visto nei mesi scorsi) su chemioterapie e trapianti di staminali in persone con HIV e concomitante patologia oncoematologica:

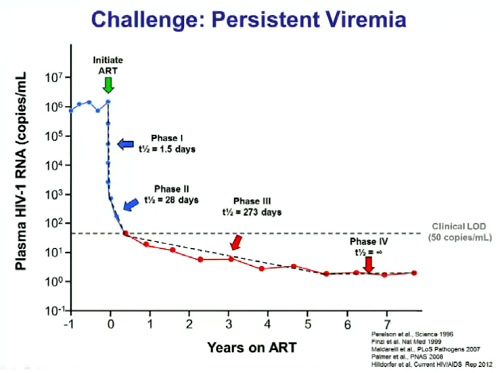
Quali sono le sfide da raccogliere per avere altri Timothy Brown? Anzitutto la comprensione e il controllo della viremia che persiste al di sotto del livello di rilevabilità nelle persone in ART soppressiva.
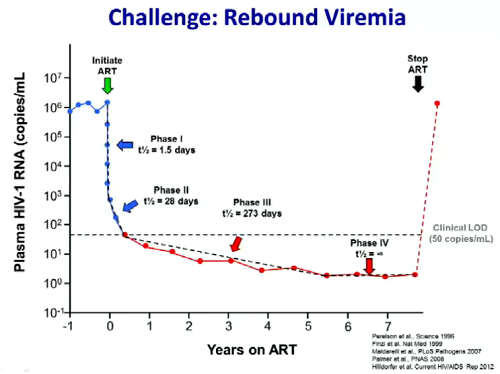
Quando si sospende la ART, in quasi tutti i pazienti si ha un più o meno immediato rebound della viremia.
Mellors sintetizza dunque le principali lacune nella nostra conoscenza della viremia e dei suoi rebound:
 Le origini della viremia persistente:
Le origini della viremia persistente:
- • si tratta di provirus che era latente e poi si è attivato?
• si tratta di cellule produttivamente infette che hanno una vita particolarmente lunga?
• si tratta di replicazione attiva (cioè di qualche santuario non raggiunto dai farmaci)?
• di quali tipi di cellule stiamo parlando? qual è la loro localizzazione anatomica?
 Le origini del rebound virale quando si sospende la ART:
Le origini del rebound virale quando si sospende la ART:
- • una cellula o molte?
• un tessuto o molti?
 Quale misura, se ne esiste una, predice il tempo del rebound?
Quale misura, se ne esiste una, predice il tempo del rebound?
- • serve un biomarker per valutare il successo delle strategie di eradicazione, qualcosa di simile all’HIV RNA per la ART.
Una seconda sfida riguarda il reservoir latente: non abbiamo una comprensione completa delle dimensioni reali del reservoir.
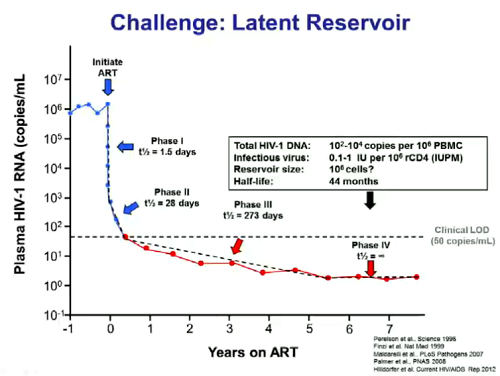
La comprensione di quale frazione di provirus latente può essere in grado di risvegliarsi e replicarsi effettivamente, dando vita a nuovi cicli di infezione apre una serie di nuove domande
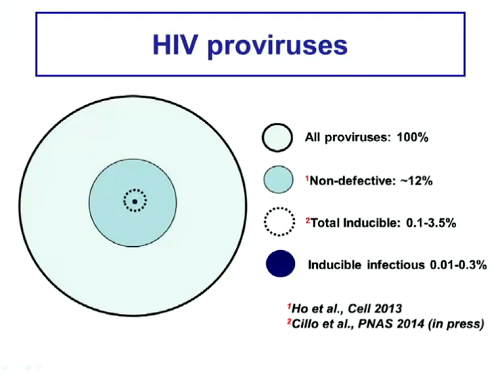
 Qual è il ruolo dei provirus latenti nel rebound virale?
Qual è il ruolo dei provirus latenti nel rebound virale?
 Quali sono i meccanismi della latenza in vivo?
Quali sono i meccanismi della latenza in vivo?
 Come si può invertire la latenza in vivo?
Come si può invertire la latenza in vivo?
 Ci sono dei provirus latenti nei tessuti? Come misurarli?
Ci sono dei provirus latenti nei tessuti? Come misurarli?
 Alcuni provirus infatti restano latenti in modo permanente?
Alcuni provirus infatti restano latenti in modo permanente?
 La latenza potrebbe essere indotta in modo permanente da qualche meccanismo?
La latenza potrebbe essere indotta in modo permanente da qualche meccanismo?
La terza sfida che verrà discussa al CROI riguarda l’emergere di sequenze identiche durante la terapia antiretrovirale e il suo significato. Dopo circa 4 anni di terapia, infatti, se si fa una analisi filogenetica di singole sequenze del genoma virale si osserva l’emergere di sequenze identiche, la cui origine non è affatto chiara.
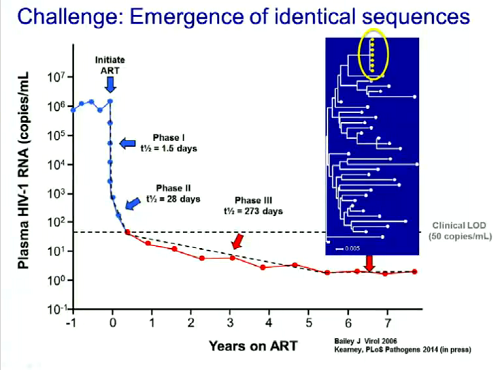
Due gruppi di lavoro (quello di Wagner, #138, e quello di Maldarelli, #407LB) hanno indagato i siti di integrazione dell’HIV in pazienti in cui sono emerse sequenze identiche. L’analisi dei siti di integrazione serve per differenziare l’espansione clonale di una singola cellula, con tutte le cellule che presentano il medesimo sito di integrazione, dalla stessa sequenza di virus che si integra in differenti siti del genoma della cellula.
Le lacune nella conoscenza dell’espansione clonale sintetizzate da Mellors sono:
 Quali sono i tipi di cellule che vengono espanse?
Quali sono i tipi di cellule che vengono espanse?
 I provirus nei cloni espansi sono intatti o difettivi?
I provirus nei cloni espansi sono intatti o difettivi?
- • Che alcuni cloni di fatto producano virioni lo sappiamo perché troviamo nel plasma dei virioni con sequenze identiche. Ma questi virioni sono infettivi oppure no?
 Non conosciamo la localizzazione dei cloni espansi.
Non conosciamo la localizzazione dei cloni espansi.
 Non conosciamo il destino di questi cloni espansi.
Non conosciamo il destino di questi cloni espansi.
 Non abbiamo idea se questi cloni risponderebbero in caso di una qualche strategia di cura.
Non abbiamo idea se questi cloni risponderebbero in caso di una qualche strategia di cura.
Esistono però anche delle sfide che riguardano
 La diversità dell’HIV e la diversità nelle risposte CTL necessarie per eliminare le cellule latentemente infette riattivate dalle strategie anti-latenza;
La diversità dell’HIV e la diversità nelle risposte CTL necessarie per eliminare le cellule latentemente infette riattivate dalle strategie anti-latenza;
 La diversità umana e le variazioni nelle storie terapeutiche (per età all’inizio della ART, fase della malattia prima dell’inizio della ART, momento dell’inizio della ART e sua durata) – tutte queste varianti influenzano le dimensioni del reservoir e le possibilità di cura;
La diversità umana e le variazioni nelle storie terapeutiche (per età all’inizio della ART, fase della malattia prima dell’inizio della ART, momento dell’inizio della ART e sua durata) – tutte queste varianti influenzano le dimensioni del reservoir e le possibilità di cura;
 I rischi inerenti ad ogni terapia sperimentale;
I rischi inerenti ad ogni terapia sperimentale;
 la necessità che ogni terapia sperimentale sia sicura ed efficace almeno quanto la ART oggi disponibile.
la necessità che ogni terapia sperimentale sia sicura ed efficace almeno quanto la ART oggi disponibile.
Queste sono tutte le ragioni per cui Mellors, all’inizio della sua lezione, ha sostenuto che l’asticella della cura è messa molto in alto.
Mellors passa poi a parlare delle diverse strategie di cura e dei diversi concetti di cura. Poiché sono questioni che qui nel forum abbiamo trattato tante volte, mi limito a postare qualche slide.
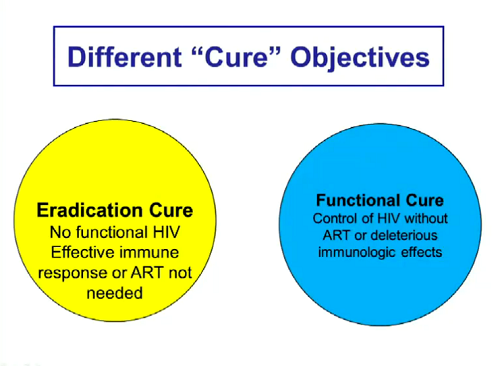
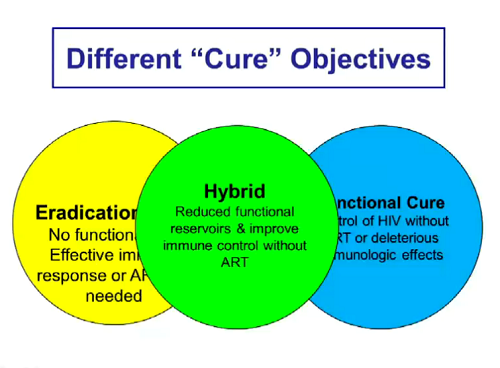
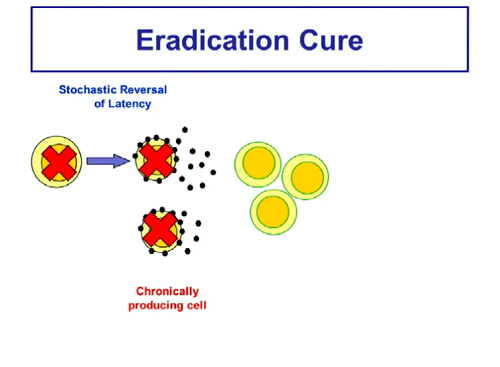
Se per “eradicazione” intendiamo assenza di HIV funzionante e non necessità di una risposta immune efficace, per arrivarci l’idea è di distruggere le cellule latenti in modo che non possano diventare produttivamente infette e così infettare altre cellule.
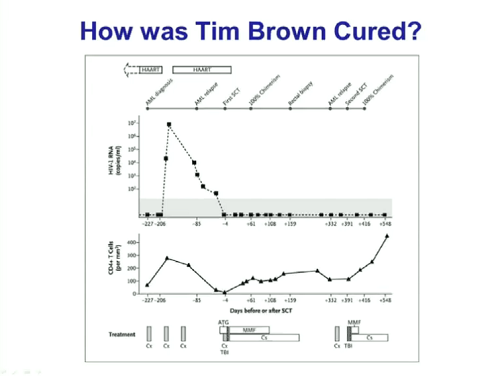
Mellors passa poi a raccontare la delusione per il rebound delle viremie dei due “Boston Patients” poco dopo la sospensione della ART e quella che segue è una tabella che riassume il tipo di trapianto e di trattamenti cui i due pazienti sono stati sottoposti. L’aspetto più inquietante di questa vicenda è naturalmente il fatto che tutti i test più sofisticati mostravano che di HIV, finché i due erano in terapia, ne restavano solo tracce infinitesimali. Questo sposta la barra dell’eradicazione ancora più in alto di quanto si potesse immaginare.

Che cosa si può fare per evitare il formarsi di reservoir in cellule che hanno vite lunghissime? Una possibilità è iniziare con la ART immediatamente dopo l’inizio dell’infezione.
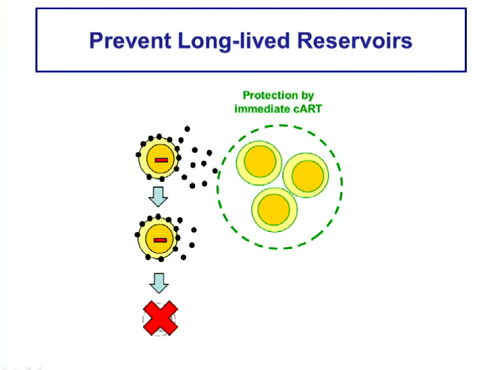
L’esempio migliore è quello della "bimba del Mississippi", di cui abbiamo sentito parlare per la prima volta l’anno scorso, proprio al CROI. Un aggiornamento e molte discussioni sono previsti anche durante questo congresso.

E di altri esempi di ART in fase acuta verranno discussi a questo CROI, perché stanno arrivando dati molto interessanti, che confermano che in chi inizia la terapia subito dopo l’infezione il reservoir di DNA virale integrato nei CD4 memoria centrali è molto più piccolo che in chi inizia la ART durante la fase cronica.

Le lacune principali in questa area sono che
 non sappiamo se altri bambini avranno la stessa sorte fortunata della piccola del Mississippi (#75LB);
non sappiamo se altri bambini avranno la stessa sorte fortunata della piccola del Mississippi (#75LB);
 non sappiamo quanto presto debba essere iniziata la ART (#136LB);
non sappiamo quanto presto debba essere iniziata la ART (#136LB);
 non sappiamo se, anche con un inizio immediato della ART, degli adulti possano essere curati (#397LB).
non sappiamo se, anche con un inizio immediato della ART, degli adulti possano essere curati (#397LB).
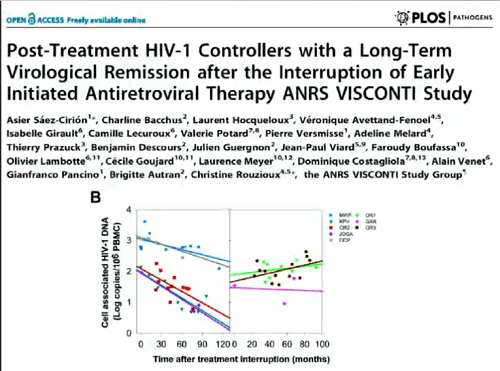
Se, invece di eradicazione, puntiamo a una "cura funzionale", cioè a un controllo dell’HIV senza la ART o senza dannosi effetti immunologici, il caso paradigmatico è quello della coorte VISCONTI, di post-treatment controllers dopo la sospensione di una ART iniziata molto presto e proseguita per vari anni:
Un obiettivo strategico intermedio è quello che Mellors ha definito “ibrido” – la riduzione di reservoir funzionanti e il miglioramento del controllo immune: può consistere in una spontanea o indotta inversione della latenza che, con l’aiuto della stimolazione dei linfociti effettori e di anticorpi eventualmente coniugati a farmaci, porta all’eliminazione delle cellule riattivate e impedisce quindi che nuovi CD4 si infettino.
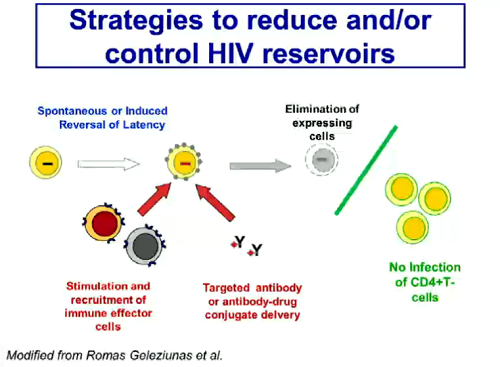
Una diapositiva è dedicata ai farmaci antilatenza di cui si parlerà al CROI: vorinostat e panobinostat.

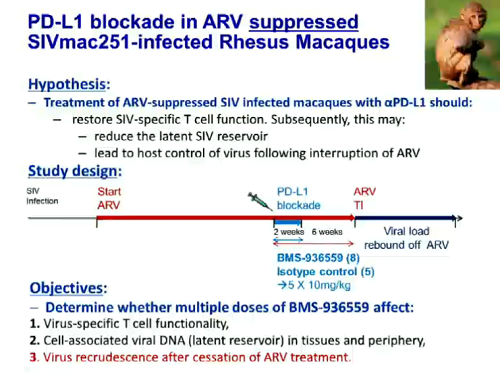
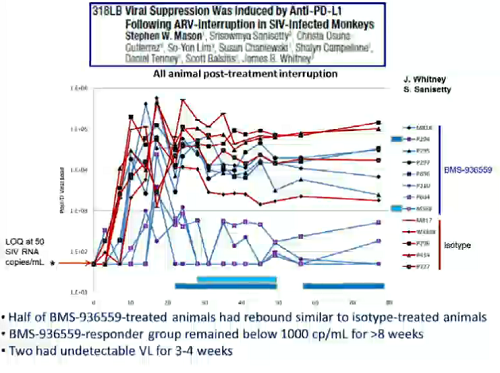
Gli approcci di immunoterapia – che si tratti di anticorpi, di terapie cellulari o di vaccini terapeutici - sono invece riassunti nella prossima slide, mentre le due successive offrono un esempio di immunoterapia, di cui abbiamo ampiamente parlato nel forum (cfr. il thread Anticancro che blocca PD-1 e PD-L1 rinforza sistema immune).

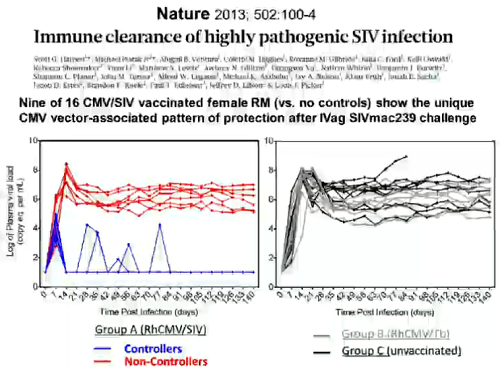
La lezione di Mellors non può ovviamente trascurare il vaccino di Louis Picker:
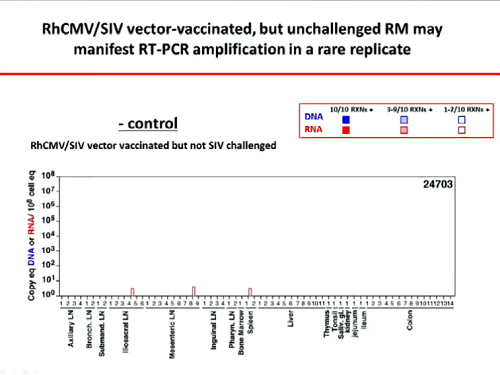
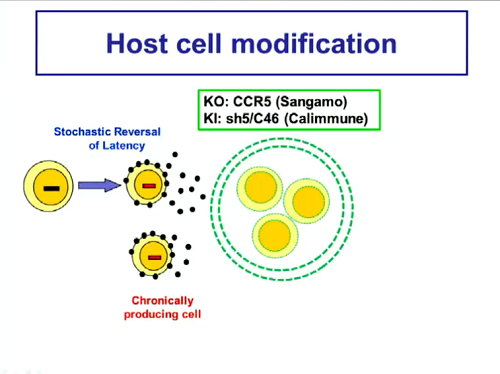
L’ultima strategia affrontata da Mellors riguarda le possibili modificazioni dell’ospite per conferirgli resistenza contro l’HIV – dunque le ricerche di Sangamo (#141) e quella di Calimmune:
Esortazione finale ai giovani ricercatori: sceglietevi la lacuna nelle nostre conoscenze che preferite, e riempitela. Sceglietevi la strategia che vi piace di più, e perseguitela con oggettività, ma anche con passione. Sarà una fantastica avventura.
