Per chi desiderasse fare confronti, poi, la lezione di Koup sugli anticorpi dell'anno scorso si trova nel thread [CROI 2016] R.Koup: Immunologia e vaccini e c'è anche una parte della lezione di John Mascola, sempre al CROI dell'anno scorso: quella sugli ANTICORPI NEUTRALIZZANTI IN FUNZIONE TERAPEUTICA AL CROI 2016.
ADVANCES IN ANTIBODIES
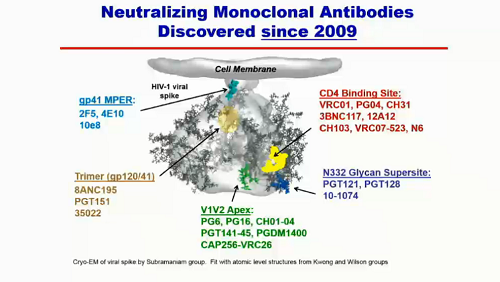
A partire dal 2009 sono stati scoperti molti anticorpi neutralizzanti ad ampio spettro, con target diversi su diverse porzioni di HIV:
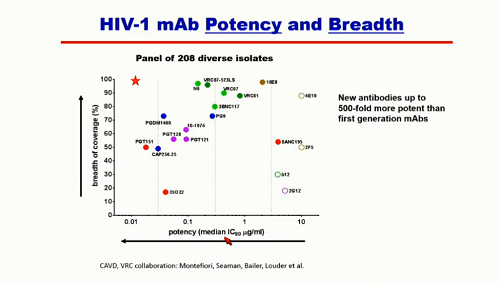
La potenza di questi nuovi anticorpi, misurata come IC80 medio, arriva ad essere più di 500 volte quella dei primi mABs scoperti. La loro ampiezza di neutralizzatione, misurata come percentuale di varianti virali che riescono a distruggere (su un numero di ceppi virali che supera il 200), in alcuni casi si avvicina al 100%. Purtroppo, alcuni degli anticorpi - come i PGT 151, 128, 121 - che sono molto potenti, non hanno l'ampiezza che serve per distruggere tutti i virus che ci sono nel mondo. L'obiettivo è di arrivare a qualcosa nella posizione della stellina rossa qui sotto: un'ottima potenza e una ampiezza vicina al 100%.
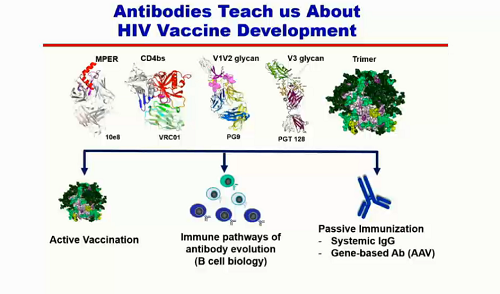
Quando questi anticorpi sono stati scoperti, si è pensato che permettessero di capire meglio la struttura del trimer, così da sapere quali epitopi vogliamo colpire in un vaccino. Poi è nata l'idea di usarli direttamente per costruire dei vaccini preventivi, e si è pensato che potessero svolgere anche un ruolo terapeutico, anzitutto spiegando come i linfociti B debbano svilupparsi nel tempo per essere capaci di attaccare questi epitopi, e in secondo luogo venendo utilizzati direttamente per un'immunizzazione passiva.
Dopo queste parole introduttive, la lezione di Koup entra nel vivo, con la spiegazione di come si possono costruire anticorpi che siano più potenti e abbiano una maggiore ampiezza di neutralizzazione.
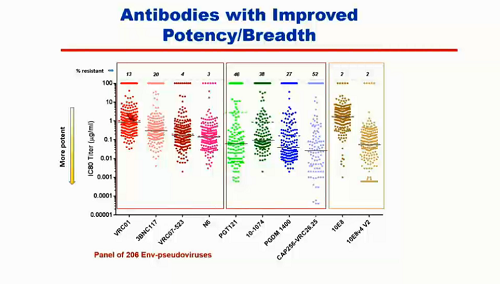
Uno dei primi bNABs scoperti è VRC01: è un anticorpo che si lega al CD4, neutralizza l'80-90% di varianti virali di tutti i ceppi esistenti, e la sua potenza è piuttosto buona.
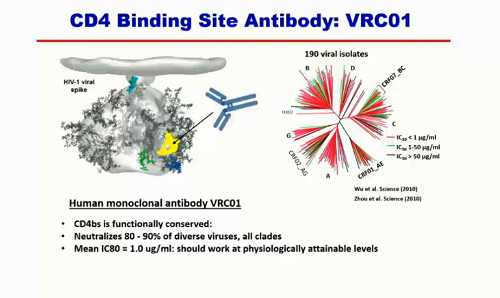
Ma quando si guarda ad altri anticorpi, si vede che VRC01 non è potente quanto questi e non sale sopra il 90% di virus neutralizzati.
Nella parte centrale dell'immagine qui sotto, si vede anche come ci sono anticorpi molto potenti, ma la cui ampiezza non è molto buona. È però possibile clonare e modificare gli anticorpi, così da renderli più potenti e accrescere la loro ampiezza di neutralizzazione.
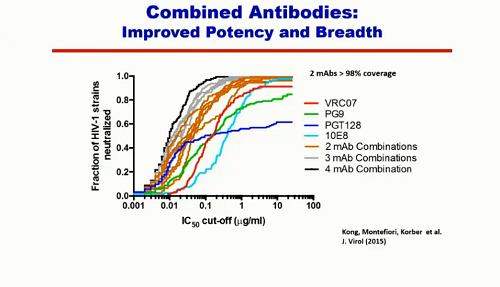
Un altro modo per migliorare potenza e ampiezza è quello di combinare l'azione di 2, 3 o 4 anticorpi diversi.
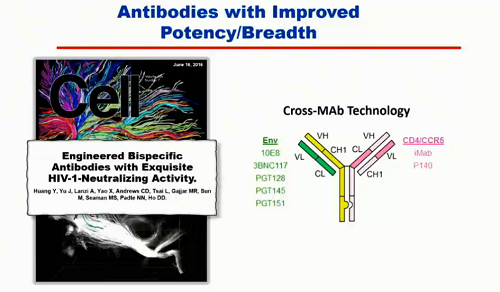
Oltre a prendere anticorpi separati e a farli agire insieme, è anche possibile - mediante una tecnologia chiamata cross-MAb - costruire un anticorpo unico a partire da due o più (un esempio, qui):
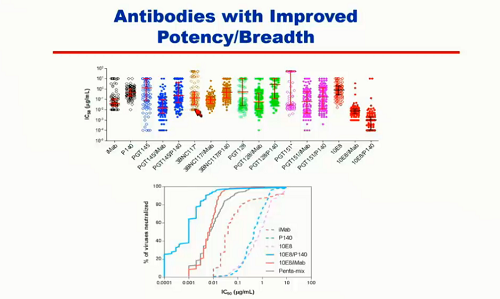
Quando questo è stato fatto, si è potuto osservare un aumento di ampiezza e potenza (cfr. 10EB e sue modificazioni nella slide qui sotto):
Gli anticorpi devono neutralizzare il virus, e questo è l'obiettivo di tutte queste ricerche. Ma si sta cercando di fare anche qualcosa di più: modulando la regione FC dell'anticorpo, se ne possono modificare sia le funzioni, sia l'emivita. Nella figura, è la parte inferiore dell'anticorpo:
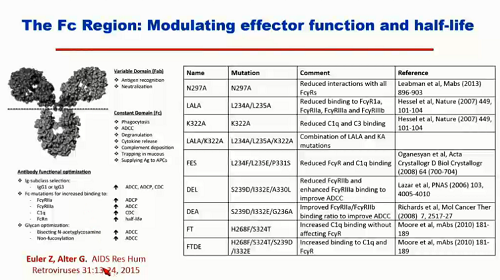
È stato possibile, modificando il frammento FC, prolungare l'emivita dell'anticorpo, in modo che resti in circolazione per un tempo molto più lungo.
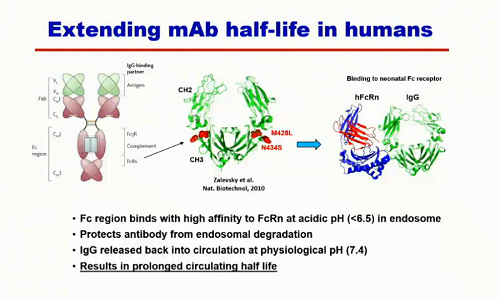
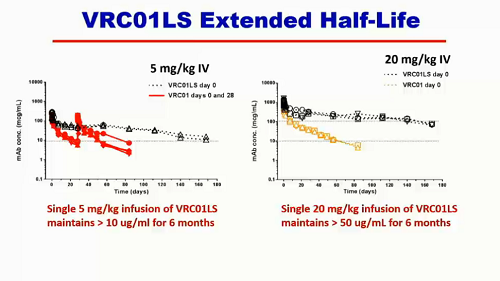
Sì è riusciti ad estendere l'emivita fino a 6 mesi:
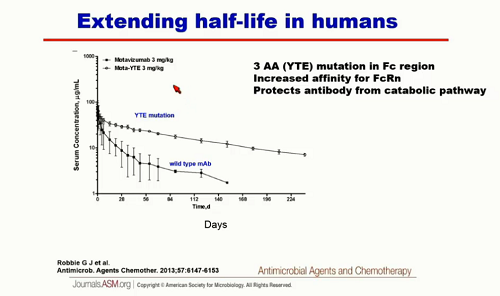
VRC01 è stato modificato per estendere la sua durata in circolo e ora è sperimentato in un trial clinico di fase I. I dati preliminari di una singola infusione di 5 mg/kg dicono che l'anticorpo rimane in circolo per 6 mesi (VRC01 non modificato per un paio di settimane). Se la dose aumenta a 20 mg/kg, per 6 mesi restano in circolo più di 50 μg, che sono livelli molto alti, senz'altro terapeutici, che consentono di pensare a una terapia long-acting e anche a una strategia di prevenzione.
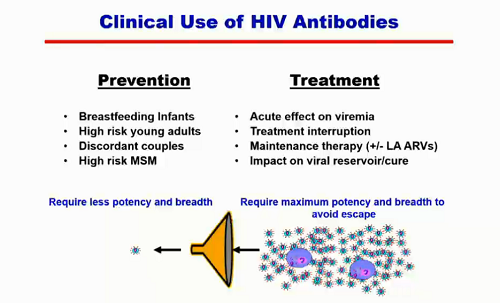
L'uso clinico degli anticorpi può essere preventivo (per bambini allattati al seno, persone ad alto rischio, coppie discordanti), e in quel caso bastano anticorpi non troppo potenti e senza grandissima capacità di neutralizzazione, perché l'anticorpo deve bloccare quelle poche varianti virali che vengono trasmesse; oppure terapeutico (per avere un effetto sulla viremia in fase acuta, durante le interruzioni della ART, durante terapie di mantenimento con o senza ARV long-acting, per cercare di avere una riduzione del reservoir latente), e allora, per evitare mutazioni di escape del virus, servono anticorpi molto potenti e dalla grande ampiezza per contrastare la gran quantità di quasispecie presenti, che si sono sviluppate nel singolo individuo come reazione ai suoi anticorpi neutralizzanti.
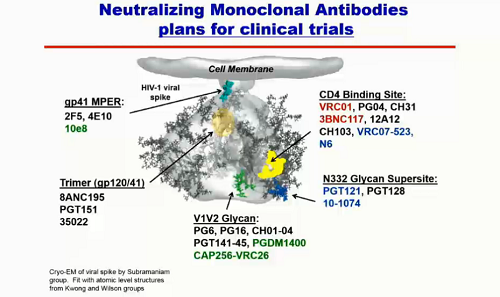
Molti degli anticorpi neutralizzanti di cui stiamo parlando sono testati in trial clinici o stanno per esserlo:
Per la prevenzione, gli anticorpi possono essere utilizzati in alternativa o insieme a diverse altre opzioni - dai gel vaginali o rettali, agli anelli vaginali, alla PrEP orale o long-acting, ai vaccini. Secondo Koup è ragionevole aspettarsi che gli anticorpi funzionino, che siano sicuri e ben tollerati e che offrano una buona protezione per periodi di tempo prolungati. Se dimostreranno in questi trial pilota di avere efficacia clinica, allora questo sarà un incentivo a produrli in scala e a utilizzarli nei vaccini. L'obiettivo adesso è di avere un anticorpo che possa essere iniettato 3 o 4 volte all'anno e dia protezione a persone ad alto rischio di contrarre l'infezione.

È da più di 20 anni che si sta studiando l'immunizzazione passiva in modelli di scimmie messe a confronto con virus chimera SHIV. Dal 2012, però, si stanno testando gli anticorpi ad ampio spettro (PGT121, 3BNC117, 10-1074 VRC01 e VRC07).
Fino ad oggi, però, sono mancati dati sull'immunizzazione passiva con anticorpi monoclonali di esseri umani.
Ora è iniziato lo studio AMP (Antibody Mediated Prevention), che deve proprio rispondere alla domanda se l'immunizzazione passiva con anticorpi monoclonali riesca a impedire ad adulti ad alto rischio di infettarsi.
Gli obiettivi del trial sono:
- 1. determinare se e a quali concentrazioni un anticorpo neutralizzante ad ampio spettro (VRC01) riesca a prevenire l'infezione;
2. se la protezione sia ottenuta a livelli di neutralizzazione che possano essere raggiunti da un vaccino;
3. se la protezione sia ottenuta a dosi che possano essere somministrate per via sottocutanea a intervalli di 2-4 mesi.
Al momento ci sono due trial aperti e queste sono le loro caratteristiche:
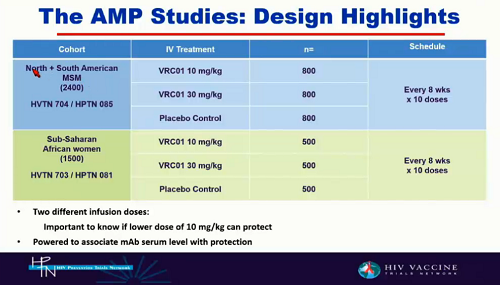
Due dosi: per vedere a quali livelli le concentrazioni di anticorpi si sovrappongano nel corso del tempo e così capire che livello di anticorpi è necessario per ottenere la protezione.
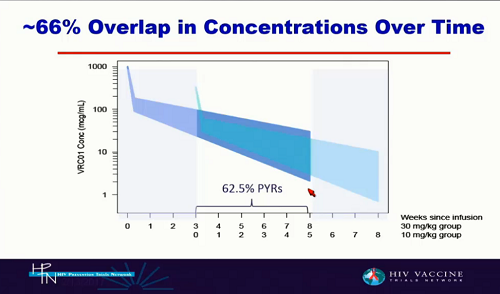
Se questo studio avrà successo, cioè se VRC01 dimostrerà di essere in grado di diminuire il rischio di infezione, sarà possibile definire i livelli di anticorpo presenti nel sangue che danno protezione. Questo, inoltre, si tradurrà in incentivi a sviluppare nuovi anticorpi più potenti e duraturi, e renderà anche possibile perseguire un'immunizzazione di tipo genetico, che fornisca livelli di anticorpi che diano una protezione a medio e lungo termine.
Sapere che i mAB sono davvero in grado di proteggere dall'infezione servirà anche a guidare la costruzione di un vaccino.
Rimangono delle domande senza risposta, in primo luogo se gli anticorpi siano davvero capaci di prevenire l'infezione e a che livelli lo riescano a fare.

Per quanto invece riguarda l'uso terapeutico dei bNABs, abbiamo già visto che si pensa di utilizzarli in tre casi molto diversi: per avere un effetto sulla viremia durante la fase acuta, durante le interruzioni della ART, durante terapie di mantenimento con o senza ARV long-acting, e per cercare di avere una riduzione del reservoir latente.
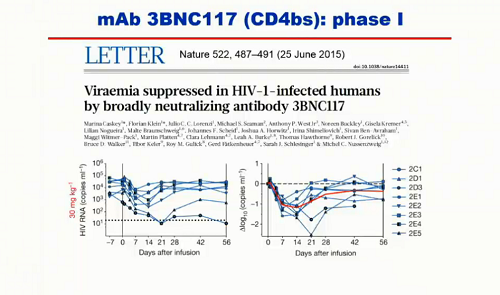
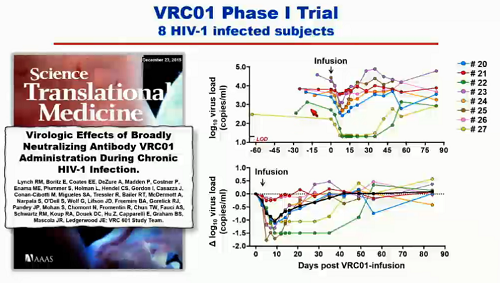
Già si è visto che gli anticorpi hanno lavorato bene nei modelli animali, e anche i trial di fase I sono andati bene, sia nella capacità dei singoli anticorpi di mantenere un certo controllo sulle viremie, sia nella loro tollerabilità.
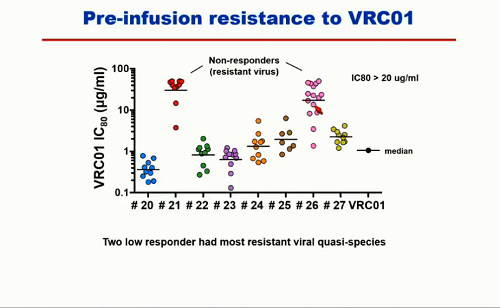
Un problema che è emerso chiaramente da queste sperimentazioni è la possibile esistenza di resistenze a questi bNABs prima ancora che vengano somministrati
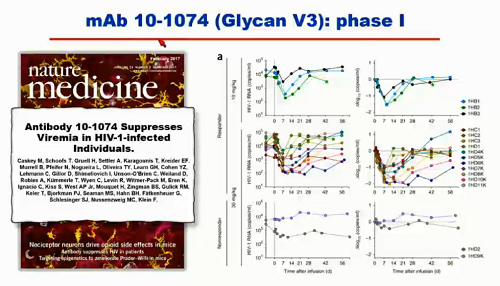
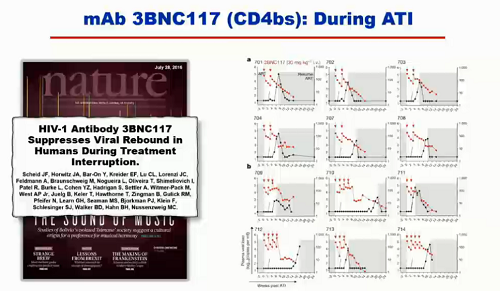
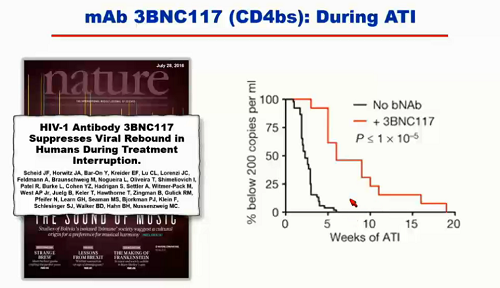
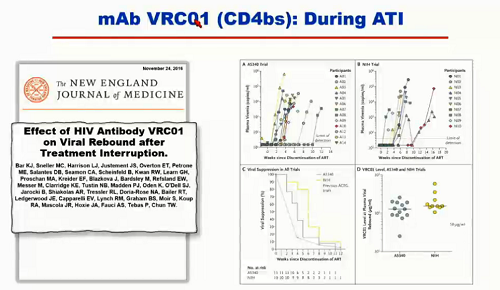
Prima di presentare i diversi studi che vedremo in questi giorni al congresso, Koup sintetizza quanto ha raccontato nella sua lezione:
- - dalla loro scoperta nel 2009, i potenti mABs contro HIV sono arrivati alle sperimentazioni cliniche molto in fretta;
- abbiamo già uno studio di fase IIb di un anticorpo usato come PrEP;
- ci sono diversi studi di fase I di singoli anticorpi usati in funzione terapeutica;
- è improbabile che un singolo anticorpo riesca a mantenere a lungo la soppressione della viremia, perché si sviluppano facilmente delle resistenze. Le vie d'uscita - che richiederanno studi molto attenti - sono:- - combinazioni di anticorpi, miglioramento della loro potenza e ampiezza, multispecificità
- combinazioni di bNAbs con ARV
- si continuano a scoprire e a costruire mABs sempre migliori;
- l'estensione della loro emivita può consentire di somministrarli ogni 3 o 4 mesi. - - combinazioni di anticorpi, miglioramento della loro potenza e ampiezza, multispecificità
Le domande sugli anticorpi come trattamento dell'infezione da HIV che ancora attendono una risposta sono queste:
- - in quali situazioni terapeutiche determinati mAB possono avere un impatto?
- - possono i mAB contribuire alla cura dell'infezione?
- è possibile superare la resistenza ai mAB, oppure questa si rivelerà il tallone d'Achille di questo approccio?
- se si riesce a risolvere il problema delle resistenze, quali livelli di potenza e di ampiezza si dovranno raggiungere per ottenere un effetto terapeutico?
- come si fa a quantificare in modo accurato la sensibilità a un mAB delle quasispecie di un singolo paziente?
- qual è il meccanismo antivirale in vivo dei mAB?- neutralizzazione? opsonizzazione? ADCC? altro?
E questi sono gli studi portati al CROI:
