SILICIANO: caratterizzazione del reservoir, studi sulla cura
Re: R: [STUDI] Siliciano: chinoline, disulfiram, reazioni CT
A questo punto allora possiamo sperare soltanto nella terapia genica o nella scoperta di un vaccino veramente efficace che riesca da solo a sconfiggere il virus...
Re: R: [STUDI] Siliciano: chinoline, disulfiram, reazioni CT
La prima pare per il momento adatta a un insieme molto limitato di pazienti e il secondo è ancora abbastanza di là da venire.admeto ha scritto:A questo punto allora possiamo sperare soltanto nella terapia genica o nella scoperta di un vaccino veramente efficace che riesca da solo a sconfiggere il virus...
Ho bisogno di riflettere ancora un bel po' sulle implicazioni di quest'ultimo lavoro di Siliciano, ma la prima cosa che mi viene da pensare è che non è detto che il colpo - effettivamente molto grave - che ha inflitto allo "Shock and Kill" *ingenuo* valga necessariamente anche per una sua versione *più sofisticata*, quale ad esempio il "Kick, Kill and Boost".
Provo a ragionare: se con una prima ondata di riattivazione spazzi via solo una parte del reservoir, hai però anche rafforzato le reazioni CTL dei CD8. Siamo sicuri che un vaccino terapeutico ben impostato non riesca ad innescare un circolo virtuoso, tale per cui il sistema immunitario sia capace di far fuori da solo il provirus che resta nel reservoir, ogni volta che questo tenta di trascriversi?
Il lavoro di Louis Picker parrebbe andare in questa direzione.
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
DISULFIRAM
Nel corso del 2013 di disulfiram non è mai capitato di parlare ed io pensavo che fosse una ricerca finita nel nulla, dati i risultati men che modesti emersi dallo studio pilota (in questo thread, che sta ormai diventando assai lungo, ne abbiamo parlato qui, qui, qui e qui).
In un certo senso era così. E se mi fossi accorta solo l'altro ieri, invece che ieri, che il 12 dicembre era uscito su Clinical Infectious Diseases un major article di Spivak, Deeks, Siliciano e colleghi, in cui si ammette senza mezzi termini l'insuccesso del disulfiram nel ridurre le dimensioni del reservoir latente in quello studio pilota del 2012, avrei scritto ieri un breve post, che sarebbe stato la perfetta conclusione di un anno davvero orrendo, in cui le bastonate che ci sono arrivate (da Siliciano, ma non solo) sono state particolarmente dure.
Ma era così solo in un certo senso. E allora inizio il 2014 con un post in cui devo, sì, raccontare di un fallimento sancito nell'anno passato, ma posso anche aprire a una piccola speranza per l'uso futuro del disulfiram - sotto altri dosaggi, per altri tempi, in modalità diverse - come farmaco anti-latenza. Infatti, ci dicono Deeks e gli altri, è vero che non si sono viste variazioni statisticamente significative nelle dimensioni del reservoir, ma è anche vero che in alcuni partecipanti al trial si sono potuti misurare degli aumenti transitori della viremia. Quindi qualcosa il disulfiram deve avere pur fatto al virus latente.
Un brevissimo riepilogo dell’articolo.
Il punto 8) è quello che dà ancora qualche speranza sul disulfiram come farmaco anti-latenza e che ci fa iniziare l’anno in una disposizione leggermente migliore rispetto a come l’abbiamo finito.
Se però proviamo a tirare le somme, quel che non possiamo negare è che, anche se il meccanismo d’azione del disulfiram è poco chiaro e il suo effetto altamente variabile da persona a persona e anche se i metodi per misurare le dimensioni del reservoir latente fanno acqua da tutte le parti, quindi è difficile dire alla fin fine che cosa misurino, il disulfiram sembra aver lasciato sostanzialmente indisturbato il reservoir.
In un editoriale che accompagna l’articolo, Martin Tolstrup (uno dei danesi che stanno sperimentando il panobinostat) si rammarica che Deeks e colleghi non abbiano misurato l’HIV RNA associato alle cellule, che è presumibilmente il test più sensibile per misurare l’attivazione della trascrizione virale.
Questo – dice Tolstrup – avrebbe potuto aumentare la probabilità di dimostrare un effetto più consistente sulla inversione della latenza. Inoltre, avrebbe permesso di confrontare direttamente la potenza di riattivazione del disulfiram e quella del vorinostat, anch’esso sperimentato per 14 giorni da Margolis e Lewin, in un trial il cui fallimento è stato sancito sempre nel 2013. Da notare che anche nel trial sul vorinostat si sono osservati aumenti statisticamente significativi della riattivazione dell’HIV nei momenti immediatamente successivi alla somministrazione del farmaco (e il parallelismo fra disulfiram e vorinostat non si ferma qui perché, come nel caso del disulfiram, anche nel trial di Margolis e Lewin non si sono visti effetti sul DNA provirale).
Vedremo dunque che cosa accadrà quando il disulfiram verrà dato per più tempo e in dosi maggiori in persone in cui abbia dimostrato di poter fare qualcosa. E vedremo se potrà essere combinato insieme ad altre sostanze anti-latenza: il suo ottimo profilo di sicurezza permette infatti di pensare che possa essere usato in sinergia con altri farmaci per riattivare la trascrizione del virus.
Quello che Siliciano ci ha insegnato nel 2013 è che anche una inversione della latenza forte e sostenuta potrebbe non essere sufficiente ad intaccare il reservoir in modo duraturo.
Quello che invece ci aveva insegnato nel 2012 era che lo “shock and kill” che abbiamo definito “ingenuo”, che riteneva che bastasse usare dei farmaci anti-latenza perché le cellule riattivate producessero virus e venissero quindi distrutte o dagli effetti del virus stesso, o dai CD8, non regge alla prova dei fatti: sembra infatti che invertire la latenza senza attivare i linfociti T non basti a distruggere i CD4 latentemente infetti.
Lo studio uscito adesso conferma quindi che lo “shock and kill” con farmaci come il disulfiram deve essere integrato con una strategia che rafforzi i CD8 nella loro opera di distruzione dei CD4 memoria quiescenti che si mettono a produrre virus.
Suggerimento di Dora per l'inizio dell'anno: si sta facendo un trial sul panobinostat senza CPG 7909 (o equivalente) e si inizierà presto un trial sull'auranofin senza BSO. Aspettiamoci dei risultati simili a quelli del disulfiram e del vorinostat, cioè che si intraveda qualche *possibile-se-pur-minimo-e-statisticamente-non-significativo* effetto sul reservoir e si prospetti dunque la necessità di nuovi trial, che oltre allo "shock" diano anche potenza al "kill", rafforzando le reazioni citolitiche dei linfociti T.
E andiamo avanti così, da una proof of concept all'altra. Intanto il tempo passa. Quanta pazienza ci vuole.
FONTI:
Nel corso del 2013 di disulfiram non è mai capitato di parlare ed io pensavo che fosse una ricerca finita nel nulla, dati i risultati men che modesti emersi dallo studio pilota (in questo thread, che sta ormai diventando assai lungo, ne abbiamo parlato qui, qui, qui e qui).
In un certo senso era così. E se mi fossi accorta solo l'altro ieri, invece che ieri, che il 12 dicembre era uscito su Clinical Infectious Diseases un major article di Spivak, Deeks, Siliciano e colleghi, in cui si ammette senza mezzi termini l'insuccesso del disulfiram nel ridurre le dimensioni del reservoir latente in quello studio pilota del 2012, avrei scritto ieri un breve post, che sarebbe stato la perfetta conclusione di un anno davvero orrendo, in cui le bastonate che ci sono arrivate (da Siliciano, ma non solo) sono state particolarmente dure.
Ma era così solo in un certo senso. E allora inizio il 2014 con un post in cui devo, sì, raccontare di un fallimento sancito nell'anno passato, ma posso anche aprire a una piccola speranza per l'uso futuro del disulfiram - sotto altri dosaggi, per altri tempi, in modalità diverse - come farmaco anti-latenza. Infatti, ci dicono Deeks e gli altri, è vero che non si sono viste variazioni statisticamente significative nelle dimensioni del reservoir, ma è anche vero che in alcuni partecipanti al trial si sono potuti misurare degli aumenti transitori della viremia. Quindi qualcosa il disulfiram deve avere pur fatto al virus latente.
Un brevissimo riepilogo dell’articolo.
- 1) Il disulfiram (nome commerciale Antabuse) è un farmaco usato per trattare l’alcolismo in circolazione da più di mezzo secolo. Questo lo rende particolarmente attraente, perché in tutti questi anni abbiamo avuto modo di conoscerlo bene e non si porta dietro pesantissimi sospetti come gli HDACi. E infatti quel che ci viene detto immediatamente nell’articolo è che è stato sicuro e ben tollerato.
2) Quando Siliciano l’aveva testato in vitro, aveva dimostrato di essere capace di indurre la trascrizione dell’HIV nei CD4 latentemente infetti, e di farlo a delle concentrazioni che possono essere usate in vivo. È stato dunque condotto uno studio, in aperto e con un solo braccio, su 16 persone con viremia soppressa dalla ART da almeno un anno (e da una mediana di 79 mesi) e più di 200 CD4 (ma la mediana dei CD4 era 600, con percentuale mediana 30%), cui sono stati dati 500 mg al giorno di disulfiram, per 14 giorni (dosaggio scelto perché permette di raggiungere in vivo concentrazioni del farmaco paragonabili a quelle che in vitro hanno causato un’inversione della latenza; la sicurezza di dosi più alte non è nota).
3) Le domande cui si voleva dare risposta erano due: - Il disulfiram è in grado di riattivare l’HIV latente in un modo che possa essere rilevato misurando aumenti nella viremia residua?
- La riattivazione dell’HIV mediante disulfiram è in grado di portare a una riduzione nelle dimensioni del reservoir latente?
- 4) Un solo paziente ha avuto un blip durante la sperimentazione, ma la viremia è tornata irrilevabile al controllo successivo.
5) Le dimensioni del reservoir sono state misurate mediante SCA (Single Copy Assay) 2 settimane prima e 10 settimane dopo la somministrazione del disulfiram. A questo secondo controllo, le dimensioni sono risultate invariate in tutti i pazienti.
6) Durante la somministrazione del farmaco la viremia residua, che è stata misurata ogni due giorni per tre settimane e poi per 9 settimane dopo la fine del trattamento, è rimasta sostanzialmente invariata rispetto ai valori di partenza. La viremia è risultata infatti mediamente 1,93 volte superiore dopo rispetto a prima (IC 95%, range 1,04 – 3,57, p = 0,039).
7) In una analisi post-hoc (quella fatta durante quest’anno di apparente silenzio), si è visto in diversi pazienti (6 su 15) un inatteso aumento rapido e transitorio della viremia in campioni prelevati immediatamente dopo la somministrazione del disulfiram: la viremia è aumentata in media di 2,96 volte (IC 95%, range 1,29 – 6,81, p = 0,014).
8) La variabilità nella risposta al disulfiram (e la corrispondente variabilità delle concentrazioni raggiunte dal farmaco nel sangue) deve ancora essere spiegata: per alcune persone, il dosaggio di 500 mg è insufficiente a innescare la riattivazione del virus latente; ma poiché circa il 50% dei pazienti di questo studio ha invece avuto un aumento della viremia di basso livello subito dopo la somministrazione del farmaco, che è stato abbastanza sostenuto da durare un paio di mesi e da indicare una tendenza (statisticamente non significativa, ma pur presente) alla riduzione delle dimensioni del reservoir, si può pensare che una maggiore esposizione al farmaco in vivo potrebbe anche comportare degli effetti maggiori e più duraturi sulla produzione dell’HIV. Questo aspetto è molto interessante anche da un punto di vista teorico, perché potrebbe confermare un’ipotesi che si sta facendo strada in questi ultimi tempi, secondo cui c’è una “soglia” della trascrizione virale (ovvero della produzione di virus) necessaria perché si inneschi il meccanismo di apoptosi (autodistruzione) delle cellule infette riattivate o perché queste cellule diventino visibili al sistema immunitario e possano essere distrutte dai CD8.
Il punto 8) è quello che dà ancora qualche speranza sul disulfiram come farmaco anti-latenza e che ci fa iniziare l’anno in una disposizione leggermente migliore rispetto a come l’abbiamo finito.
Se però proviamo a tirare le somme, quel che non possiamo negare è che, anche se il meccanismo d’azione del disulfiram è poco chiaro e il suo effetto altamente variabile da persona a persona e anche se i metodi per misurare le dimensioni del reservoir latente fanno acqua da tutte le parti, quindi è difficile dire alla fin fine che cosa misurino, il disulfiram sembra aver lasciato sostanzialmente indisturbato il reservoir.
In un editoriale che accompagna l’articolo, Martin Tolstrup (uno dei danesi che stanno sperimentando il panobinostat) si rammarica che Deeks e colleghi non abbiano misurato l’HIV RNA associato alle cellule, che è presumibilmente il test più sensibile per misurare l’attivazione della trascrizione virale.
Questo – dice Tolstrup – avrebbe potuto aumentare la probabilità di dimostrare un effetto più consistente sulla inversione della latenza. Inoltre, avrebbe permesso di confrontare direttamente la potenza di riattivazione del disulfiram e quella del vorinostat, anch’esso sperimentato per 14 giorni da Margolis e Lewin, in un trial il cui fallimento è stato sancito sempre nel 2013. Da notare che anche nel trial sul vorinostat si sono osservati aumenti statisticamente significativi della riattivazione dell’HIV nei momenti immediatamente successivi alla somministrazione del farmaco (e il parallelismo fra disulfiram e vorinostat non si ferma qui perché, come nel caso del disulfiram, anche nel trial di Margolis e Lewin non si sono visti effetti sul DNA provirale).
Vedremo dunque che cosa accadrà quando il disulfiram verrà dato per più tempo e in dosi maggiori in persone in cui abbia dimostrato di poter fare qualcosa. E vedremo se potrà essere combinato insieme ad altre sostanze anti-latenza: il suo ottimo profilo di sicurezza permette infatti di pensare che possa essere usato in sinergia con altri farmaci per riattivare la trascrizione del virus.
Quello che Siliciano ci ha insegnato nel 2013 è che anche una inversione della latenza forte e sostenuta potrebbe non essere sufficiente ad intaccare il reservoir in modo duraturo.
Quello che invece ci aveva insegnato nel 2012 era che lo “shock and kill” che abbiamo definito “ingenuo”, che riteneva che bastasse usare dei farmaci anti-latenza perché le cellule riattivate producessero virus e venissero quindi distrutte o dagli effetti del virus stesso, o dai CD8, non regge alla prova dei fatti: sembra infatti che invertire la latenza senza attivare i linfociti T non basti a distruggere i CD4 latentemente infetti.
Lo studio uscito adesso conferma quindi che lo “shock and kill” con farmaci come il disulfiram deve essere integrato con una strategia che rafforzi i CD8 nella loro opera di distruzione dei CD4 memoria quiescenti che si mettono a produrre virus.
Suggerimento di Dora per l'inizio dell'anno: si sta facendo un trial sul panobinostat senza CPG 7909 (o equivalente) e si inizierà presto un trial sull'auranofin senza BSO. Aspettiamoci dei risultati simili a quelli del disulfiram e del vorinostat, cioè che si intraveda qualche *possibile-se-pur-minimo-e-statisticamente-non-significativo* effetto sul reservoir e si prospetti dunque la necessità di nuovi trial, che oltre allo "shock" diano anche potenza al "kill", rafforzando le reazioni citolitiche dei linfociti T.
E andiamo avanti così, da una proof of concept all'altra. Intanto il tempo passa. Quanta pazienza ci vuole.
FONTI:
- - Editoriale di Tolstrup: Reversing Latency in HIV-infected Patients
- Articolod di Spivak –Deeks: A Pilot Study Assessing the Safety and Latency Reversing Activity of Disulfiram in HIV-1-Infected Adults on Antiretroviral Therapy
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
- Perché le sostanze anti-latenza hanno finora dato così cattiva prova di sé nelle sperimentazioni cliniche?
In questi anni abbiamo visto fallire tutti i trial clinici “proof of concept” fatti per sperimentare qualche farmaco anti-latenza: lasciando perdere il debolissimo acido valproico, hanno fatto o stanno facendo una brutta fine il disulfiram, il vorinostat e il panobinostat – uno apparentemente più potente dell’altro. E anche le prospettive della romidepsina non si può dire che siano rosee, mentre di briostatina e prostratina in fase clinica dubito che sentiremo parlare in tempi ragionevoli.
Da profana, mi sono chiesta: perché tutte queste sostanze, che in vitro sembrano funzionare bene o addirittura benissimo e delle quali si sono misurate le diverse capacità di riattivare il virus latente (senza al tempo stesso attivare in massa tutti i CD4) in modo così preciso da poterle mettere in scala di potenza, quando finalmente vengono sperimentate in vivo, sembra che al virus che dorme non riescano a fare neppure il solletico?
Che cosa non funziona nei diversi modelli cellulari perché si rivelino così poco affidabili nel predire che cosa accadrà davvero nel corpo dei pazienti?
E in particolare: perché nei modelli riesci a stabilire che una sostanza è più potente di un’altra nel forzare la trascrizione del virus, e anche di quanto è più potente, e invece i risultati delle sperimentazioni cliniche sono molto simili (e vicini allo zero) per le diverse sostanze?
In questi anni, mi è capitato di leggere decine di lavori in cui si lamentava il fatto che nessun modello cellulare della latenza riesce da solo a catturare l’estrema complessità della realtà. Parallelamente, in ogni articolo, in ogni presentazione a un congresso, c’è sempre qualche ricercatore che sottolinea quanto sia difficile misurare correttamente il reservoir - una valutazione da cui non si può prescindere se si vuole capire se i farmaci antilatenza stanno avendo qualche effetto oppure no.
E già l’anno scorso, nell’ultima ricerca di cui abbiamo parlato in questo thread, dal laboratorio di Siliciano era venuta la dimostrazione che quello che è considerato il gold standard per misurare le dimensioni del reservoir latente – il Quantitative Viral Outgrowth Assay (QVOA) – non riesce a individuare la presenza di genomi provirali dopo che questi sono stati riattivati in vitro, mentre la PCR riesce ad amplificare un certo numero di “provirus non indotti” - tanto che Margolis - non ricordo più in quale occasione recente - ammise che, finché non si trova un modo per valutare davvero le dimensioni del reservoir, ogni trial clinico rischia di essere una semplice presa in giro.
Prima di arrivare alla sperimentazione in vivo, mancava inoltre un approfondito passaggio dai modelli in vitro alle cellule prelevate ex vivo da pazienti con viremia soppressa dalla terapia.
Questo passaggio l’ha fatto adesso Siliciano e qualche risposta comincia ad arrivare.
La ricerca è stata presentata al CROI tre settimane fa, ma ieri è uscito il relativo articolo su Nature Medicine, quindi metterò insieme qualche diapositiva della presentazione di Gregory Laird con quel che io ho recepito dell’articolo molto tecnico di Siliciano.
Detto molto brutalmente: nessuno dei farmaci antilatenza (latency-reversing agents – LRAs) sperimentati finora ha dimostrato di saper ridurre le dimensioni del reservoir latente in persone con HIV.
Il trattamento ex vivo con vorinostat di cellule di persone infette ha indotto, in certi studi, uno certo riattivarsi del virus, mentre in altri studi non si è visto neppure quello. Ma in vivo di produzione virale non se ne è vista.
Mancava finora una strategia validata ex vivo di confronto fra le diverse sostanze antilatenza, ed è quello che ha fatto Siliciano in questa ricerca, cercando di indurre la trascrizione virale in circa 5 milioni di CD4 quiescenti con vari LRAs e utilizzando tre test differenti per misurarne gli effetti. I test sono stati:
- 1. l’induzione di produzione virale – a indicazione di un’avvenuta inversione della latenza (Viral Outgrowth Assay – un tipo di test creato e ora modificato nel laboratorio di Siliciano);
2. il rilascio di virus libero fuori dalle cellule;
3. la produzione di HIV-1 mRNA intracellulare. È il metodo più comune per misurare mediante PCR l’induzione della trascrizione dell’HIV e consiste nella misura degli RNA che contengono sequenze della proteina Gag dell’HIV. Il problema - come viene dimostrato nell'articolo - è che anche se sono stati documentati aumenti di HIV-1 mRNA nei trial sul vorinostat di Margolis e di Lewin, questo metodo di misurazione non è del tutto affidabile, perché l'HIV mRNA può essere generato come risultato della trascrizione di geni umani entro i quali il virus si è integrato. Ma questo fenomeno non è la stessa cosa dell'attivazione del virus e non porta alla replicazione dell'HIV e alla produzione di virioni, che è la ragione per cui si usano i farmaci antilatenza.
Nei modelli cellulari, vorinostat, romidepsina, panobinostat, disulfiram e briostatina-1, dati in concentrazioni clinicamente accettabili, avevano dimostrato di poter invertire efficacemente la latenza senza avere effetti tossici sui CD4 quiescenti.
Le slides seguenti mostrano invece come da tutti e tre i tipi di test si sia visto che le singole sostanze anti-latenza non hanno causato produzione di virus nelle cellule prelevate dai pazienti con viremia soppressa dalla ART. Invece, trattando le cellule in coltura con PMA (forbolo miristato acetato) + ionomicina, un mix che causa attivazione cellulare e non può dunque essere usato nella clinica, tutte le cellule di tutti di pazienti hanno prodotto virus, che è stato possibile quantificare con un Viral Outgrowth Assay standard.
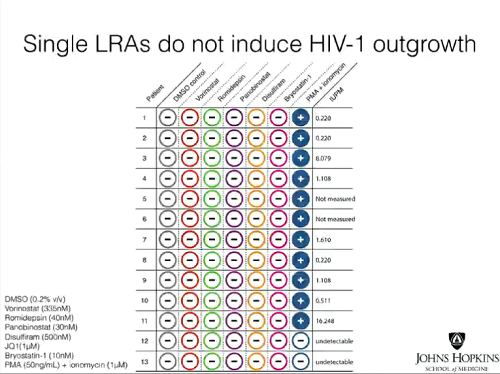
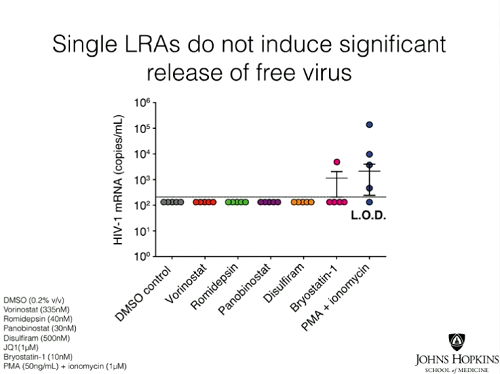
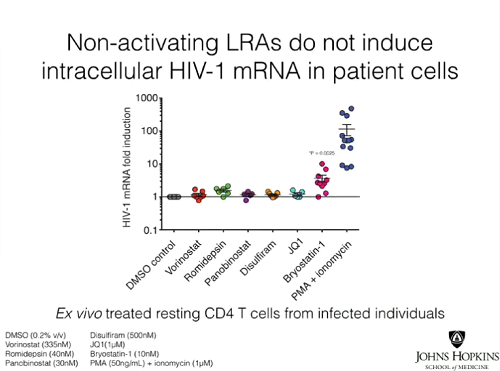
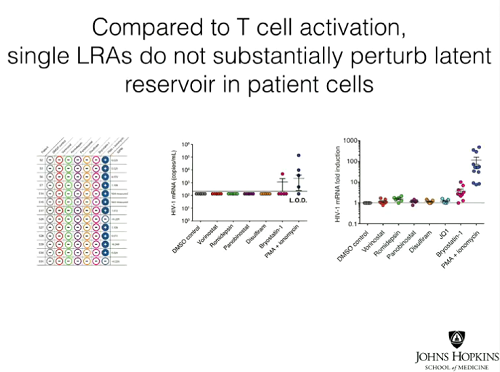
Le conclusioni dell’articolo:
- I nostri dati dimostrano che nessuno dei principali candidati testati, fra le sostanze che invertono la latenza senza riattivare i linfociti T, è riuscito a distruggere in modo significativo ex vivo il reservoir latente. Il contrasto fra gli effetti dei LRAs nei modelli di latenza dell’HIV-1 in vitro e i loro effetti ex vivo nei CD4 quiescenti di persone infette in ART indica che questi modelli non catturano completamente tutti i meccanismi che governano la latenza dell’HIV-1 in vivo. È improbabile che queste sostanze portino all’eliminazione del reservoir latente in vivo quando somministrate individualmente.
L’unica sostanza efficace quando usata da sola è l’agonista della PKC [protein-chinasi C] briostatina-1, che probabilmente è troppo tossica per essere usata nella clinica.
Rimane da capire se altri agonisti della PKC o altre sostanze che stimolano meccanismi associati all’attivazione dei linfociti T possano essere abbastanza sicuri da essere somministrati ai pazienti ed è possibile che ulteriori progressi dipendano dal trovare delle combinazioni di LRAs che siano sicure e attive.
Con questo l’articolo si chiude.
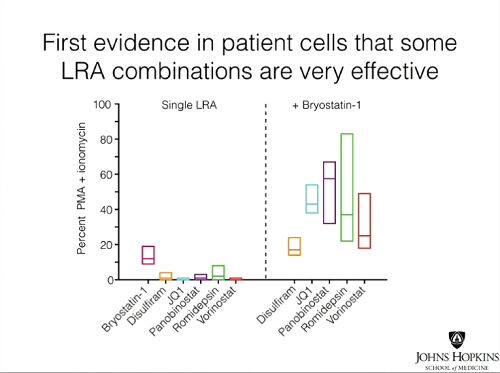
Invece, la lezione tenuta al CROI da Gregory Laird ci lascia con qualche speranza in più, perché ci mostra come alcune combinazioni di sostanze anti-latenza abbiano dimostrato di poter lavorare insieme, inducendo una maggior produzione di virus nelle cellule latentemente infette prelevate dai pazienti. Si è infatti osservato un potente ed efficace effetto sinergico quando sono stati uniti il panobinostat e soprattutto la romidepsina alla briostatina.
DdD: si sta preparando una terapia combinata anti-latenza, una specie di cALT?
FONTI:
- - Presentazione di Gregory Laird al CROI: Novel Ex Vivo Approaches Distinguish Effective and Ineffective Drugs for Reversing Latency In Vivo.
- Articolo su Nature Medicine: New ex vivo approaches distinguish effective and ineffective single agents for reversing HIV-1 latency in vivo.
- Comunicato stampa: Drugs fail to reawaken dormant HIV infection.
- Articolo del Siliciano Lab su PLoS Pathogens 2013 sulla validazione di un Rapid Viral Outgrowth Assay per misurare la frequenza di cellule che possono rilasciare virus capace di replicazione dopo essere state riattivate: Rapid Quantification of the Latent Reservoir for HIV-1 Using a Viral Outgrowth Assay.
- Articolo di Janet Siliciano e molti altri su PLoS Pathogens 2013 su uno studio comparativo di diversi test usati per misurare le dimensioni del reservoir: Comparative Analysis of Measures of Viral Reservoirs in HIV-1 Eradication Studies.
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
Di là dal fatto che oramai, per evitare le mie furie, ti stai piegando a essere una sorta di wannabe del lieto fine  , stavo considerando che l’infausta sequenza di fallimenti evidenziati dal tuo amore di italiane origini, ha un merito: mette in evidenza (tragicamente, ahinoi) la differenza tra ricerca in vitro e passaggio ai sistemi complessi (animali vivi), e spiega perché la ricerca su questi ultimi sia fondamentale, ma vabbe’, si scivola nella filosofia…
, stavo considerando che l’infausta sequenza di fallimenti evidenziati dal tuo amore di italiane origini, ha un merito: mette in evidenza (tragicamente, ahinoi) la differenza tra ricerca in vitro e passaggio ai sistemi complessi (animali vivi), e spiega perché la ricerca su questi ultimi sia fondamentale, ma vabbe’, si scivola nella filosofia…
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
Di là dal fatto che non mi dimentico dove scrivo, io non sono una uffa come te. Ci provo sempre a cercare gli aspetti positivi - e in questo caso ce ne sono parecchi:uffa2 ha scritto:Di là dal fatto che oramai, per evitare le mie furie, ti stai piegando a essere una sorta di wannabe del lieto fine…
- la sinergia dei LRAs - è dimostrata, anche se si dovrà vedere se si riuscirà a rendere utilizzabile la briostatina e in che dosi si potranno mescolare diverse sostanze anti-latenza;
- l'arrivo della cALT - con il facile pronostico che tutti adesso diranno che l'avevano sempre pensato che ci voleva una strategia anti-latenza combinata e assisteremo a una corsa a chi salta per primo sul carro;
- un nuovo test ex vivo che sta funzionando bene e che potrà essere usato da tutti i laboratori che vorranno valutare la riattivazione del virus latente;
- un'operazione di pulizia, che impedisce di nascondere la polvere sotto il tappeto.
In questi giorni, rilfettendo sul CROI, avevo una gran paura che qualcuno mi chiedesse di tirare le somme e di dover mettere in fila questa sequela di trial andati male.stavo considerando che l’infausta sequenza di fallimenti evidenziati dal tuo amore di italiane origini, ha un merito: mette in evidenza (tragicamente, ahinoi) la differenza tra ricerca in vitro e passaggio ai sistemi complessi (animali vivi), e spiega perché la ricerca su questi ultimi sia fondamentale, ma vabbe’, si scivola nella filosofia
Non credo che Siliciano abbia il merito di aver evidenziato la sequenza di fallimenti: sono nelle cose, li abbiamo visti arrivare e ne abbiamo discusso perfino qui. Inoltre, che i modelli cellulari siano inadeguati lo dicono un po' tutti ed è il pessimo segnale di quanto noi siamo stupidi di fronte alla complessità del mondo. Lui però, a differenza di altri che tendono ad arrampicarsi sugli specchi, ne ha preso atto e ha cercato di capire perché le cellule dicevano una cosa e i sistemi complessi tutt'altra.
Solo che, ecco, una volta di più l'impressione che mi danno le ricerche di Siliciano è che mettano a nudo i limiti enormi degli altri ricercatori (non è un bel ruolo, se aspiri ad essere popolare).
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
se una sera, dietro l'angolo, qualcuno lo riempisse di bastonate, ci sarebbero interi congressi di sospettiDora ha scritto:Solo che, ecco, una volta di più l'impressione che mi danno le ricerche di Siliciano è che mettano a nudo i limiti enormi degli altri ricercatori (non è un bel ruolo, se aspiri ad essere popolare).
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
Ti consiglio di tenerti molto lontano da Baltimora.uffa2 ha scritto:se una sera, dietro l'angolo, qualcuno lo riempisse di bastonate, ci sarebbero interi congressi di sospettiDora ha scritto:Solo che, ecco, una volta di più l'impressione che mi danno le ricerche di Siliciano è che mettano a nudo i limiti enormi degli altri ricercatori (non è un bel ruolo, se aspiri ad essere popolare).
Sappi che, se succede qualcosa a Bob, ti denuncio senza pensarci due volte.
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
oh, non ho bisogno di prendere un volo intercontinentale: sono sicuro che tanti di quelli che lo abbracciano ai congressi hanno già ordinato una mazza da baseball su Amazon 
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: [STUDI] Siliciano: chinoline, disulfiram, reazioni CTL
- La critica di David Margolis.
Margolis ha pubblicato ieri per Natap il suo solito, utilissimo, report sulla cura al CROI e, analizzando le due presentazioni sul panobinostat e sul vorinostat, conferma quel che mi è parso di aver capito e ho dunque scritto nei miei post dei giorni scorsi:
- Complessivamente, lo schema di risposta [visto nella sperimentazione sul panobinostat] pare molto simile a quello mostrato da Lewin nel suo studio di somministrazione quotidiana di vorinostat per 14 giorni (…). Come avvenuto nello studio di Lewin e in quello pubblicato da Archin et al (Nature 2012 [l’altro trial sul vorinostat, quello di Margolis stesso]), si è avuto un evidente aumento di RNA virale associato alle cellule il primo giorno di somministrazione. Tuttavia, come nello studio di Lewin, l’aumento di RNA associato alle cellule nei giorni successivi è stato variabile, non sempre associato con il dosaggio, e stranamente è continuato per molte settimane senza che venisse somministrato il farmaco. Il livello di HIV DNA su un milione di CD4 è transitoriamente diminuito dai valori di partenza fino al 14° giorno, ma poi è tornato ai livelli di partenza. Non ci sono stati cambiamenti rispetto al basale nell’HIV DNA integrato. Invece, il nostro studio di dosi multiple di vorinostat non ha mostrato una induzione ripetuta di RNA virale associato alle cellule.
È opinione di chi scrive che, anche se la capacità degli inibitori dell’iston-deacetilasi di distruggere la latenza è stata dimostrata in 3 studi [clinici], non è ancora chiaro come somministrare dosaggi multipli di un HDACi per ottenere l’effetto desiderato di una distruzione della latenza dell’HIV che sia tollerabile, sicura ed efficace.
Questa situazione – a parere di Margolis - è resa ancora più incerta da due ricerche:
- 1) l’analisi fatta da Sharon Lewin sugli effetti del vorinostat sull’espressione genica dei pazienti, in cui Lewin ha visto che gli effetti dell’HDACi sulla cromatina si verificano entro il primo giorno, dopo la prima dose di farmaco, e che dopo 14 giorni di somministrazione continua entrano in gioco dei meccanismi di compensazione, che portano alla repressione della trascrizione e alla sopravvivenza della cellula;
2) e la ricerca di Siliciano di cui stiamo parlando.
Ecco la critica di Margolis alla ricerca presentata al CROI da Gregory Laird:
- Anche se gli HDACi possono essere somministrati in sicurezza, Laird ha messo in discussione la possibilità stessa che possano mai avere di per sé una qualche efficacia clinica. Laird e colleghi nel laboratorio di Siliciano hanno valutato gli effetti di sostanze candidate a invertire la latenza (LRAs) sui CD4 quiescenti di persone infette in ART soppressiva.
Essi hanno fatto due modifiche chiave nei test che hanno utilizzato per eseguire lo studio. Anzitutto, hanno testato i LRAs per vedere la loro capacità di indurre la fuoriuscita del virus dalle cellule latentemente infette dei pazienti. Tuttavia, quando hanno trattato i CD4 quiescenti purificati dai pazienti in ART con i singoli LRAs per 18 ore e poi li hanno messi in coltura per andare a cercare l’HIV, hanno usato come target delle linee cellulari MOLT-4/CCR5, invece che delle PBMC primarie attivate (allogeniche) di un donatore HIV negativo da cui erano stati esclusi i CD8.
Questo è stato fatto per una ragione encomiabile: per rimuovere la possibile stimolazione incrociata dalle cellule del donatore a quelle del paziente. Le cellule MOLT sono prive dell’antigene HLA e quindi non danno questa stimolazione. Tuttavia, le cellule MOLT (come tutte le linee cellulari) consentono una replicazione dell’HIV significativamente meno efficiente. Quindi è possibile che questo nuovo test, anche se permette di rappresentare in modo più “puro” l’attività dei LRAs testati, sia anche un test che rileva l’attività di LRAs molto potenti. Il disulfiram, il JQ1, la briostatina-1 e gli HDACi vorinostat, romidepsina e panobinostat sono stati testati a concentrazioni clinicamente rilevanti, e in effetti in questo sistema nessuno di questi LRAs ha indotto fuoriuscita di virus dalle cellule di nessuno dei pazienti analizzati.
Margolis ne fa anche un'altra di critica a Siliciano sul secondo test utilizzato per valutare la capacità degli LRA di indurre la trascrizione dell'HIV - la PCR usata per misurare l'HIV mRNA intracellulare. Ma è decisamente troppo difficile per me. Non sono in grado di capirla, figuriamoci di scriverla!
Ho capito solo che deve essersi sentito punto sul vivo, perché Siliciano a sua volta ha criticato il tipo di test usato nell'articolo su Nature di Archin etc. (cioè Margolis stesso) e l'ha modificato.