CURA FUNZIONALE DI DUE MACACHI SU QUATTRO CON IL TRIOSSIDO D'ARSENICO - uno studio proof of concept
La pubblicazione su Advanced Science di un bel lavoro di ricercatori dei Guangzhou Institutes of Biomedicine and Health guidati da Ling Chen, che è anche membro della Accademia delle Scienze Cinese, ci permette di parlare di triossido di arsenico in funzione anti-latenza: Arsenic trioxide impacts viral latency and delays viral rebound after termination of ART in chronically SIV infected macaques.
È una ricerca complessa, che si è svolta in fasi diverse - progressivamente dai modelli cellulari di latenza a cellule prelevate da macachi con SIV e esseri umani con HIV, fino a un test direttamente sui macachi - e ne vedremo in breve i diversi passaggi. Ma prima: che cos'è il triossido d'arsenico e perché lo si è usato come sostanza anti-latenza?
Il triossido d'arsenico (o ossido arsenioso) è la versione buona dell'arsenico: se l'arsenico (As) è un potente veleno, con una lunghissima storia come strumento di intrighi e delitti - come dimenticare Mitridate e, per giungere a tempi a noi più vicini, i 600 mariti noiosi fatti passare a miglior vita nel XVII secolo dall'Acqua Tofana? -

il suo triossido (As2O3) può essere usato come farmaco. E lo è nella medicina cinese a partire dal I secolo e.v., dove è chiamato Pi Shuang - 砒霜 ed è usato per trattare una pletora di malattie che vanno dalla scrofola alla malaria alla sifilide, fino all'asma con flegma freddo.

Ma lo è anche nella medicina scientifica, da una ventina d'anni almeno. È usato infatti per trattare in particolare due forme di cancro: l'epatocarcinoma e la leucemia promielocitica (nome commerciale: Trisenox®).
Chi ha seguito negli anni le ricerche di Andrea Savarino ricorderà forse un post di un paio d'anni fa:
IAS 2017 - OSTACOLARE LA FORMAZIONE DEL RESERVOIR LATENTE MEDIANTE BUTIONINA SULFOSSIMINA. APPROFONDIMENTI SUL LATO BUONO DELLO STRESS OSSIDATIVO.
Vi raccontavo di una ricerca presentata a IAS 2017 da Iart Shytaj, che costituiva il proseguimento di un brevetto del 2009 di Savarino e Lusic, che era stato seguito da un importante lavoro del 2013 di Mauro Giacca e Marina Lusic. Qui si era utilizzato il triossido d'arsenico per degradare una proteina implicata nella latenza di HIV, la PML (promyelocytic leukemia protein). Questa proteina è la componente principale dei corpi nucleari, delle strutture che si trovano nel nucleo dei CD4 memoria quiescenti e, attaccandola con il triossido d'arsenico, Lusic aveva dimostrato che si favoriva la riattivazione della trascrizione del virus.
Nel poster che avevano presentato a Parigi, Savarino, Shytaj e Lusic avevano investigato la capacità del triossido d'arsenico di generare stress ossidativo per impedire al virus di andare in latenza e così formare quei reservoir che costituiscono l'ostacolo principale a una cura dell'infezione da HIV.
Non ho citato questi lavori a caso, perché costituiscono la base su cui i ricercatori cinesi hanno impostato la ricerca di cui parliamo oggi.
Seguiamo il loro ragionamento.
Sappiamo che il triossido d'arsenico può attivare diversi meccanismi di segnalazione e stimolare alcuni fattori che sono critici nella trascrizione di HIV (PML-NB [promyelocytic leukemia nuclear body], come abbiamo visto, ma anche altri fattori di trascrizione che ci capita spesso di vedere nei post sulla ricerca di una cura: PKC, NF-kB e altri). E sappiamo che in modelli cellulari di latenza è riuscito a indurre l'attivazione di HIV latente.
Sappiamo anche che, sempre in modelli cellulari, può agire in sinergia con altre sostanze anti-latenza, per esempio HDACi come l'acido valproico e il vorinostat, o modulatori della protein-chinasi C come la briostatina-1.
Non sappiamo però se il triossido d'arsenico è in grado di attaccare in vivo il reservoir di SIV/HIV.
Per prima cosa, Ling Chen e colleghi hanno quindi riconfermato che il triossido d'arsenico riesce a riattivare il provirus latente sia in cellule J-Lat, sia in CD4 quiescenti prelevati a macachi con infezione da SIVmac239 e in uomini con infezione da HIV-1 controllate mediante antiretrovirali. E che funziona riattivando la trascrizione virale a concentrazioni micromolari senza effetti citotossici significativi (sotto i 20 μM, perché a dosaggi superiori i danni alle cellule divenivano evidenti).
Poi hanno indagato gli effetti del triossido d'arsenico sull'attivazione, proliferazione e infiammazione dei linfociti T, prelevando le cellule PBMC ai macachi, mettendole a contatto con concentrazioni diverse del farmaco per 24 ore e fino a 5 giorni e facendo un confronto con quanto accadeva trattando le cellule con PMA e ionomicina (come sempre si fa quando si vogliono attivare in massa le cellule e ci si augura che, invece, il composto studiato non lo faccia).
Anche in questo caso, risultati estremamente incoraggianti: con l'arsenico a 12,5 μM, nessun aumento significativo di marker di attivazione come CD25, CD69, HLA-DR, né sui CD4, né sui CD8. Neppure aumenti della proliferazione.
Anche sul fronte infiammatorio le cose sono andate bene: niente aumenti dei livelli di citochine come IL-1β, IL‐6, IL‐8 e IFN‐γ, mentre si sono avuti aumenti del TNF‐α solo a concentrazioni più alte del farmaco, che potrebbero dipendere dal fatto che il triossido d'arsenico ha indotto apoptosi cellulare. Quando poi le cellule sono state stimolate con lipopolisaccaride per far loro produrre IL-1β, IL‐6, IL‐8 e IFN‐γ, si è visto che il triossido d'arsenico sopprimeva la produzione di citochine infiammatorie stimolata dall'LPS.
Insomma, ottime notizie su tutti i fronti: IL TRIOSSIDO D'ARSENICO È IN GRADO DI RIATTIVARE I PROVIRUS LATENTI SENZA SCATENARE QUELLA ATTIVAZIONE DEI LINFOCITI T E QUELLE RISPOSTE INFIAMMATORIE CHE RISCHIANO DI VANIFICARE OGNI TENTATIVO DI SVUOTARE IL RESERVOIR.
A quel punto Ling Chen e colleghi erano pronti a testare gli effetti terapeutici del triossido d'arsenico in vivo.
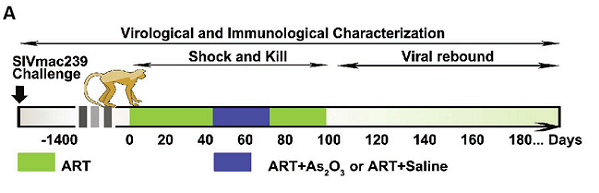
Hanno quindi preso 8 macachi rhesus cinesi con infezione cronica da SIVmac239 controllata da 5 anni da tenofovir e emtricitabina, simili per viremia, peso ed età, e li hanno divisi in 2 gruppi: a 4 hanno continuato a dare solo la cART, mentre ad altri 4 hanno somministrato anche iniezioni intravena di Naweiya, la versione cinese del Trisenox usato da noi. Il dosaggio somministrato ai macachi è stato lo stesso che si usa per curare la leucemia promielocitica negli esseri umani (0,16 mg/kg).
Quando tutti i trattamenti sono stati sospesi, nei 4 macachi trattati solo con cART si è avuto il rebound delle viremie nei tempi attesi (media di 22 giorni). Invece, nei macachi trattati anche con triossido d'arsenico il rebound è stato notevolmente ritardato. Così notevolmente che in 2 scimmie proprio non c'è stato - almeno per gli 80 giorni di durata del follow up, che non sono ovviamente un tempo infinito, ma comunque ragguardevole, soprattutto trattandosi di scimmie (cfr la fig. 4B qui sotto).

Non ci sono stati blip significativi nelle viremie. Ciò nondimeno, è stato possibile misurare delle diminuzioni del DNA provirale nei CD4 dei macachi trattati con l'arsenico, cosa che invece non si è verificata nei macachi trattati con la sola cART. Nei primi, inoltre, si è osservata una ricostituzione immunitaria che nei secondi non c'è stata.
Tutto questo permette quindi di ipotizzare che il triossido d'arsenico sia in grado di ridurre in vivo il reservoir latente di SIV/HIV.
I ricercatori cinesi non si sono fermati a questo, perché hanno anche indagato il presunto meccanismo di azione del triossido d'arsenico sul reservoir e sono giunti alla conclusione che si tratta della capacità di questo farmaco di sotto-regolare l'espressione del recettore CD4 e del co-recettore CCR5 sui linfociti T CD4. Questi sono recettori critici per il virus, perché costituiscono le "porte" attraverso cui si attacca alle cellule e penetra nel loro interno. Sotto-regolando la loro espressione, il triossido d'arsenico rende difficile, se non impossibile, al virus riattivato dalla latenza trovare nuove cellule da infettare.
Ling Chen e colleghi hanno infine dimostrato che il triossido d'arsenico aumenta le risposte anti-SIV specifiche che favoriscono l'eliminazione delle cellule infette.
Quindi, mettendo insieme tutti questi risultati, ABBIAMO UN FARMACO CHE, IN COMBINAZIONE CON LA cART, STIMOLA LA PRODUZIONE DI VIRUS LATENTE, REGOLA LA RISPOSTA IMMUNE VIRUS-SPECIFICA, SOTTO-REGOLA I RECETTORI CHE PERMETTONO AL VIRUS DI AGGREDIRE LE CELLULE. E TUTTO QUESTO LO FA SENZA UNA ATTIVAZIONE SISTEMICA DEI LINFOCITI T CHE VANIFICHEREBBE TUTTO IL LAVORO E A DOSAGGI TERAPEUTICI CHE NON HANNO DEVASTANTI EFFETTI CITOTOSSICI.
Un lavoro uscito su Blood nel 2009 racconta di una persona con HIV che ha sviluppato una leucemia promielocitica refrattaria ad altre chemioterapie ed è stata mandata in remissione completa mediante trattamento con triossido d'arsenico.
Direi che ci sono abbastanza ragioni per sperare che il triossido d'arsenico arrivi ad essere sperimentato in un trial clinico su persone con HIV ben controllato dalla cART.
Ieri ho chiesto ad Andrea Savarino se c'è la possibilità che questo trial lo faccia lui. Pare di sì. Spero quindi al più presto di poter aggiornare questo thread.