Credo che, anche senza andare troppo indietro nel tempo, per inquadrare meglio questa lezione sia utile rivedere questi due thread: [CROI 2015] J. Coffin: Ricerca di una cura dell’HIV, in particolare il primo post e quello intitolato ESPANSIONE DEL RESERVOIR IN VIVO PER PROLIFERAZIONE CLONALE, e [CROI 2016] H. Günthard: Ostacoli e strategie di cura.
HIV RESERVOIRS: OBSTACLES TO AN HIV CURE
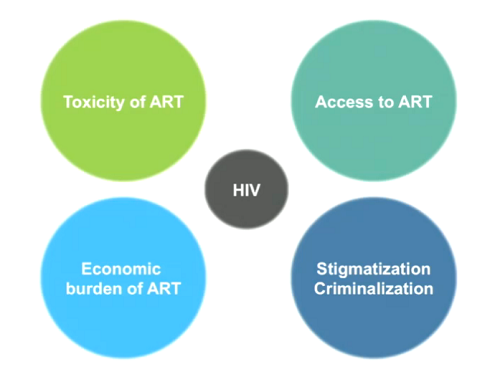
La domanda con cui Chomont dà inizio alla sua lezione è: perché ci serve una cura, se le persone con HIV controllano bene l'infezione con la ART? Perché dobbiamo fare meglio di così?
Le risposte sono nella prima slide: perché alcuni farmaci hanno delle tossicità, perché non tutti hanno accesso alla ART facilmente, perché le persone con HIV, anche se sono in terapia, sono ancora criminalizzate e stigmatizzate, e infine perché ci vuole moltissimo denaro per mantenere le persone in ART. Quindi il razionale del trovare una cura è: perché con una cura si supererebbero tutti questi problemi.
Il principale ostacolo alla cura è dimostrato dal fatto che anche persone in terapia da molti anni, se sospendono la ART, vedono il virus tornare rilevabile, a livelli paragonabili a quelli di prima di iniziare la terapia. Quindi chiaramente il virus persiste durante la fase in cui non è rilevabile: da questo stabile reservoir il virus può reinnescare l'infezione.

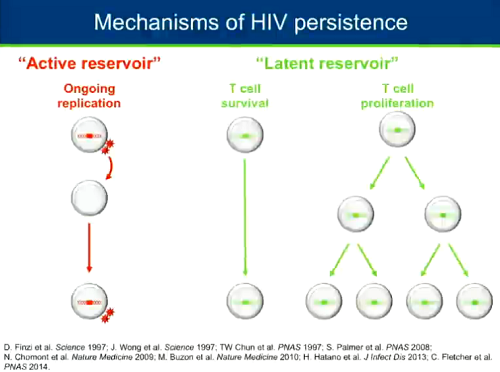
Diversi meccanismi possono contribuire alla persistenza di HIV in persone in terapia antiretrovirale. Il primo è la possibilità che il virus continui a replicarsi a bassi livelli, in particolare nei tessuti: vedremo che ci sono delle evidenze sia contro, sia a favore di questo possibile meccanismo.
Quello su cui c'è consenso fra gli scienziati è il fatto che HIV stabilisce un reservoir latente nei CD4 e forse anche in altre cellule e queste cellule latentemente infette possono persistere anche per tempi molto lunghi. Inoltre, si è capito di recente che esse possono anche proliferare a bassi livelli, mantenendo inalterate le dimensioni del serbatoio di cellule latentemente infette.
Chi conosce Harry Potter sa che non si deve pronunciare il nome del cattivo nel libro o nel film. Il nome di Lord Voldemort non compare mai, così che non accadano brutte cose. La domanda se HIV continui a replicarsi durante la ART è il Lord Voldemort nella ricerca di una cura di HIV. Quindi non si dovrebbe fare questa domanda se non si conoscono le persone che si hanno di fronte. E questo è proprio quello che è accaduto l'anno scorso, scatenando una specie di rissa (anche se nessuno lì si è preso a pugni, vedere i post LA REPLICAZIONE ATTIVA DI HIV NEI *SANTUARI FARMACOLOGICI* CONTRIBUISCE A RIEMPIRE I RESERVOIR IN PERSONE CON VIREMIA SOPPRESSA DALLA ART e DA DOVE VIENE IL REBOUND VIRALE? Una delle controversie più interessanti nella ricerca su HIV di questi anni).
I pro e i contra della replicazione persistente durante la ART sono:
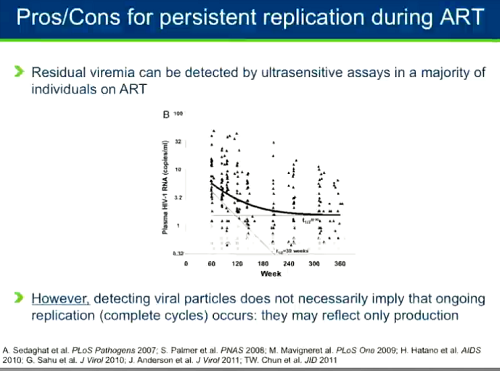
- - con test ultrasensibili si può rilevare della viremia residua nella maggior parte delle persone stabilmente in terapia;
- tuttavia, il fatto di rilevare delle particelle virali non implica necessariamente che si verifichino dei cicli completi di replicazione attiva - è possibile che sia il reservoir che di tanto in tanto si riattiva e produce virus senza che questo sia capace di riprodursi.
La seconda questione è che:
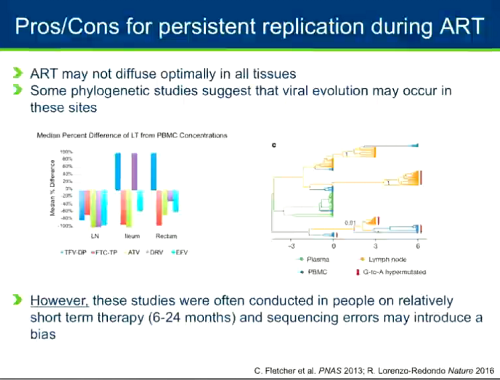
- - è possibile che la ART non arrivi sempre in modo ottimale in tutti i tessuti (specialmente nei linfonodi, nell'ileo e nel retto) - alcuni studi filogenetici (molto controversi, su cui si continua a discutere molto) suggeriscono che in questi siti si verifichi una certa evoluzione del virus;
- tuttavia, questi studi in genere sono stati fatti su persone che erano in terapia da relativamente poco tempo (6-24 mesi); inoltre gli errori fatti nel sequenziamento possono introdurre un bias.
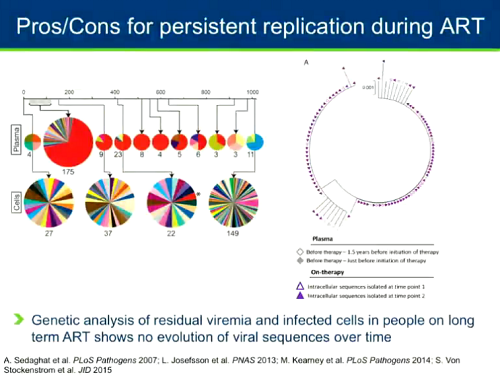
Ci sono altri studi, fatti dal gruppo di Siliciano e da quello di Sarah Palmer, che hanno indagato la diversità del reservoir nel tempo e la diversità della viremia residua e hanno mostrato che la viremia residua e il virus nelle cellule latentemente infette in persone da lungo tempo in ART non mostrano evoluzione delle sequenze virali. Questo starebbe a indicare che non c'è replicazione virale.
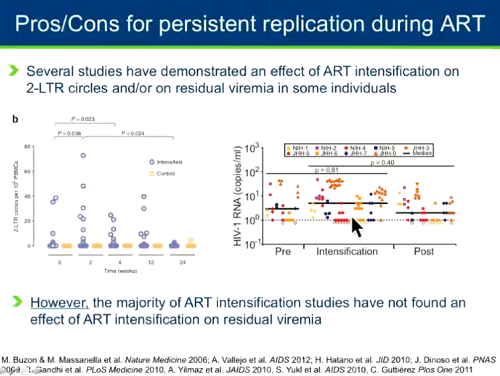
Ci sono poi gli studi di intensificazione della ART, fatti aggiungendo un farmaco al regime standard: alcune di queste ricerche hanno mostrato un effetto dell'intensificazione sui circoli 2-LTR o sulla viremia residua di alcune persone e questo pare indicare che forse in qualcuno c'è della replicazione residua che può essere inibita aggiungendo un farmaco. La maggior parte degli studi, però, non ha visto nessun effetto sulla viremia residua.
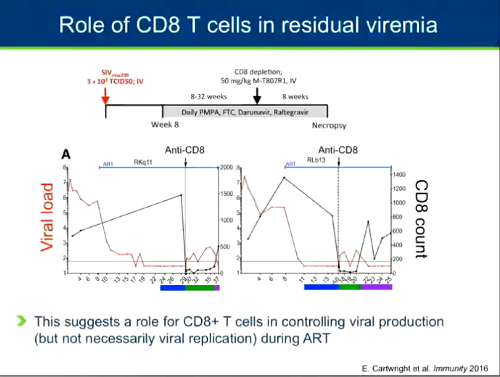
Più di recente, il gruppo di Guido Silvestri ha studiato l'impatto dei CD8 sulla viremia residua. Hanno usato un modello di infezione basato sui macachi e hanno visto che, se si distruggono i CD8, si ha un improvviso aumento della viremia anche se le scimmie continuano a essere in terapia. Questo suggerisce che i CD8 contribuiscano anche al controllo della produzione virale durante la ART (cfr. il post UN DUETTO DINAMICO: IL LEGAME VIRTUOSO FRA cART E CD8).
Di nuovo Chomont sottolinea che produzione virale non significa necessariamente replicazione virale.
Moltissimi studi portati al CROI sono dedicati alla replicazione residua o alla sua assenza - sessioni orali (O-11) e sessioni di poster (P-E1).
Chomont passa poi a parlare di latenza e dei meccanismi che causano la persistenza del virus in stato latente, consentendogli di sopravvivere anche molti anni. La prima evidenza del fatto che il virus può sopravvivere in stato latente si è avuta nel 1995, quando Siliciano ha dimostrato che alcune cellule di persone in terapia non producono virus ma, se sono messe a coltura con sostanze che le attivano, cominciano a produrre virus.
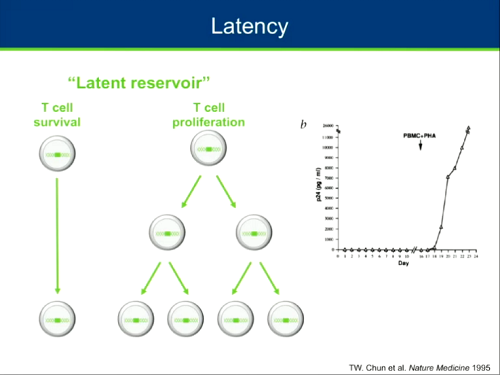
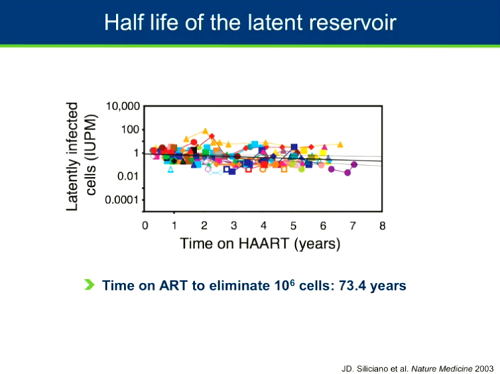
Il reservoir latente è estremamente stabile e ha un'emivita estremamente lunga: servirebbero più di 70 anni per eliminare con la ART da sola un reservoir di 1 milione di cellule. Evidentemente un obiettivo non realistico.
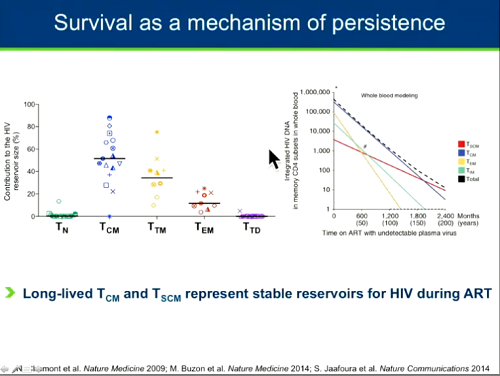
La complessità viene anche dal fatto che i CD4 non sono tutti uguali. HIV può nascondersi in diversi sottogruppi di CD4, ciascuno dei quali ha meccanismi diversi di sopravvivenza, di auto-rinnovamento e di proliferazione.

Diversi studi - fra cui quello fondamentale di Chomont stesso del 2009 - hanno indagato i meccanismi di persistenza della latenza di HIV nei diversi sottogruppi di CD4. Sono tutti concordi nel ritenere che il virus persista di preferenza nei CD4 della memoria centrale e in quelli con caratteristiche simili a quelle delle cellule staminali - tutte cellule che hanno una vita molto lunga e possono sopravvivere per molti decenni.
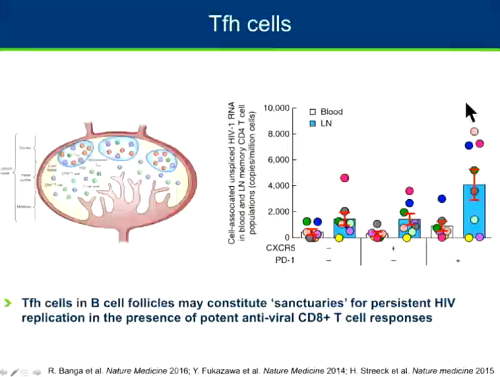
Un altro sottogruppo di CD4 che è stato identificato di recente come reservoir è quello dei CD4 follicolari, che risiedono nei follicoli, cioè nei centri germinali, dei linfociti B e possono costituire un santuario di replicazione consistente perché la loro localizzazione li protegge dall'azione dei CD8 (cfr. il post QUEL MALEDETTO SANTUARIO DEI CD4 FOLLICOLARI).
La sessione di poster PE-3 è specificamente dedicata a indagare dove HIV si nasconde.
Oltre alla sopravvivenza dei linfociti T, un altro meccanismo di persistenza del reservoir in persone in terapia è la proliferazione: più le cellule proliferano, più il reservoir è stabile; più le cellule proliferano, minore è la diversità del reservoir.
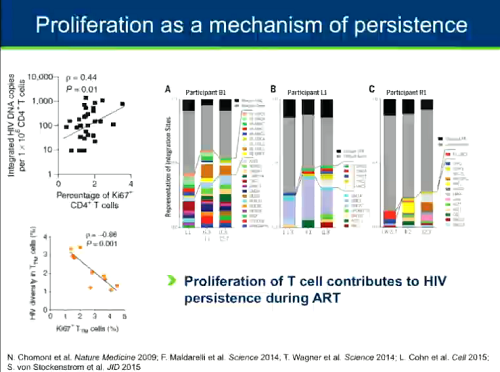
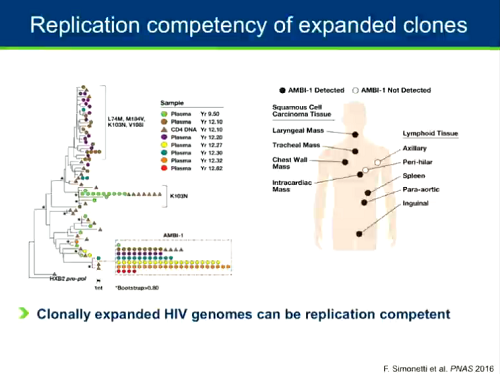
In persone trattate per periodi molto lunghi, la maggior parte del reservoir sembra risiedere in cellule che si sono espanse clonalmente. Che il virus espanso clonalmente sia o meno capace di replicarsi è una questione cui è stata data risposta l'anno scorso: sì (cfr. i post ESPANSIONE DEL RESERVOIR IN VIVO PER PROLIFERAZIONE CLONALE e Huldrych Günthard - The HIV Latent Reservoir: Obstacles and Strategies to a Cure).
La questione - una delle più affascinanti in questo campo di ricerca - è così importante che ha visto una proliferazione di lavori sui cloni portati al CROI quest'anno (sessioni orali e poster): è uno degli hot topics di questo congresso.
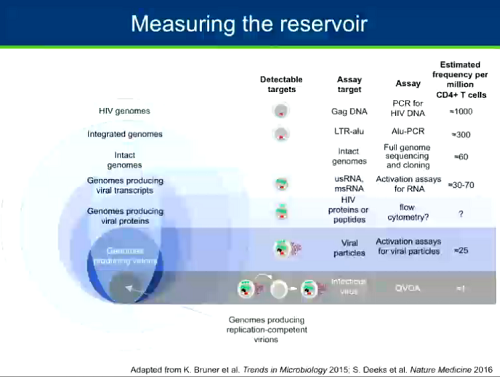
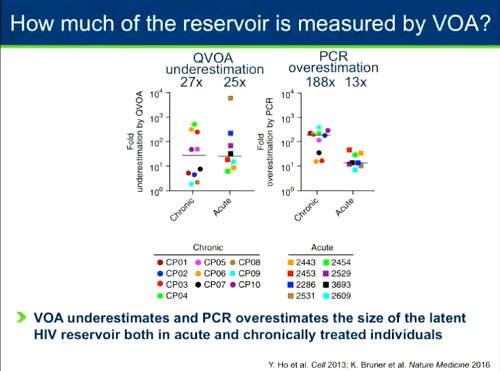
Altra questione importante e molto dibattuta è quella di come misurare il reservoir. Ci sono modi diversi per misurarlo, dal più semplice che misura il DNA virale mediante PCR, che ha il problema di non riuscire a distinguere fra provirus capaci di replicarsi e provirus difettivi, a metodi via via più complessi e sofisticati, che misurano l'RNA virale sotto diverse forme, o le proteine di HIV, o il rilascio di particelle virali. Quello che è considerato il gold standard è il VOA (Viral Outgrowth Assay) quantitativo, un test molto complesso, che ha già quasi 20 anni e che valuta la frequenza di CD4 che ospitano virus capace di replicazione. Il problema è che neppure il qVOA riesce a misurare esattamente le dimensioni del reservoir.
Tutti questi metodi di misurazione o sottostimano o sovrastimano le dimensioni del reservoir. Nella slide qui sotto si può osservare un confronto fra qVOA e PCR: dello stesso reservoir danno misure completamente diverse, con il qVOA che dà valori di più di 2 log inferiori rispetto a quelli dati dalla PCR.
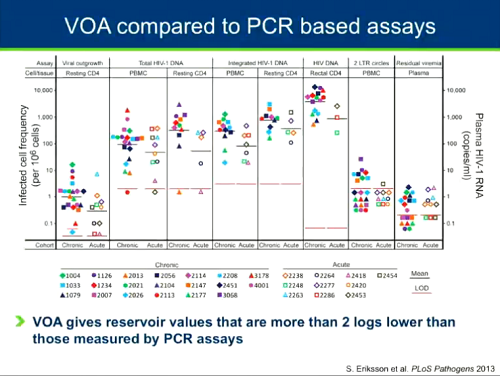
Il gruppo di Siliciano e Ya-Chi Ho ha studiato a fondo la natura del reservoir, per capire quanto di esso sia capace di replicazione e quanto provirus sia invece difettivo, quanto possa essere misurato con il qVOA e quanto con la PCR e come si differenzi il reservoir di persone trattate in fase acuta rispetto a quello di persone entrate in terapia durante la fase cronica. In sintesi: il qVOA sottostima, mentre la PCR sovrastima, le dimensioni del reservoir latente in entrambi i casi di terapia precoce o tarda. Mentre però la sottostima del qVOA è simile per i reservoir di terapia precoce o tarda, la sopravvalutazione fatta dalla PCR dei reservoir di chi ha iniziato la ART in fase cronica è molto più alta che per i reservoir di chi è entrato in terapia in fase acuta.
Esiste un nuovo test per caratterizzare il reservoir. Ne parlerà Daniel Kaufmann giovedì durante il simposio VISIONS OF HIV CURE.
Chomont passa finalmente a parlare delle strategie di cura, che nella sostanza devono rispondere alla domanda: che cosa possiamo fare per liberarci del reservoir?
La prima cosa che si può fare è limitare la dimensione del reservoir mettendo le persone molto presto in terapia.
La seconda cosa è tentare di ridurre le dimensioni del reservoir e lo si può fare sostanzialmente in tre modi: rendendo le cellule sane resistenti a HIV, distruggendo le cellule infette e obbligando il reservoir latente a riattivarsi per poi spazzarlo via (shock and kill).
La terza cosa che si può fare è controllare il reservoir mediante un vaccino o un'immunoterapia.
Poiché i thread da linkare per la strategia shock and kill e i suoi problemi, per le sostanze anti-latenza e i vaccini terapeutici, e per la terapia genica sarebbero troppi, cfr. direttamente le pagine della sezione Verso una cura.
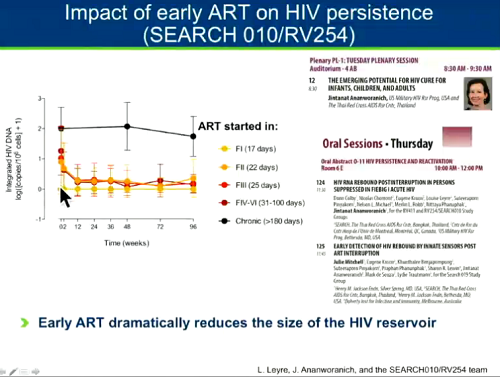
Quando si è studiato l'impatto della ART precoce sulla persistenza di HIV si è visto che era enorme: la ART in fase acuta è probabilmente il modo migliore a disposizione per incidere significativamente sulle dimensioni del reservoir. Prima si tratta una persona, più piccolo sarà il suo reservoir. Ma non solo: prima si tratta una persona, più rapidamente il suo reservoir decresce (cfr. il thread ARV in fase acuta: cura funzionale? diminuisce il reservoir?).
Ananworanich porta i risultati di uno studio su persone trattate nelle primissime fasi dell'infezione.
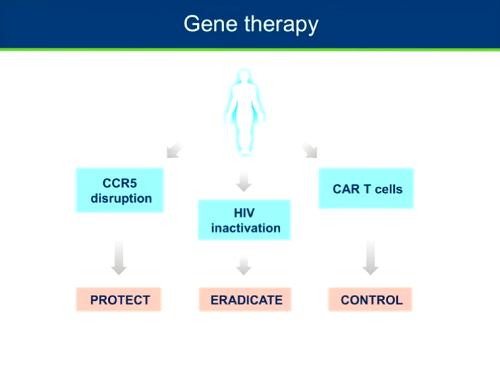
C'è poi la terapia genica, che persegue strade diverse: la distruzione del CCR5 per proteggere le cellule dall'infezione, l'inattivazione del genoma di HIV integrato nel genoma delle cellule per eradicare il virus, la generazione di linfociti CAR-T per migliorare il controllo immune sulla replicazione di HIV.
Il CROI offre presentazioni e poster su ciascuna di queste tecniche.
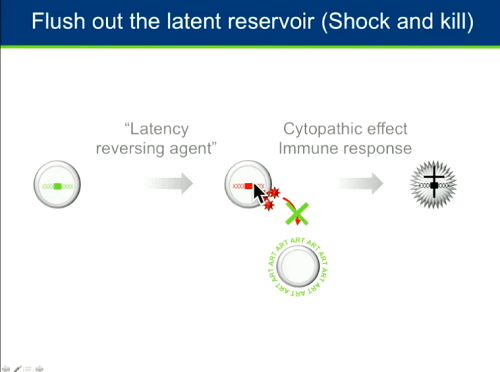
Lo shock and kill è una strategia che ha ricevuto tantissimo interesse in questi anni: prevede che, mediante farmaci chiamati "sostanze anti-latenza", si forzi l'espressione dei geni di HIV, così da obbligarlo ad uscire dalla latenza. Inducendo la produzione virale nelle cellule latentemente infette, l'obiettivo è che queste cellule muoiano o per gli effetti del virus o per intervento del sistema immunitario. Al tempo stesso, le particelle virali che tentano di produrre nuovi cicli di infezione devono essere bloccate dalla ART per proteggere dall'infezione le cellule circostanti.
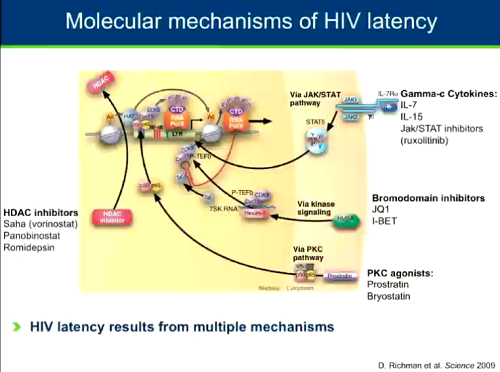
I meccanismi molecolari della latenza di HIV sono complessi, ma possono essere attaccati in diversi punti da diversi tipi di farmaci.
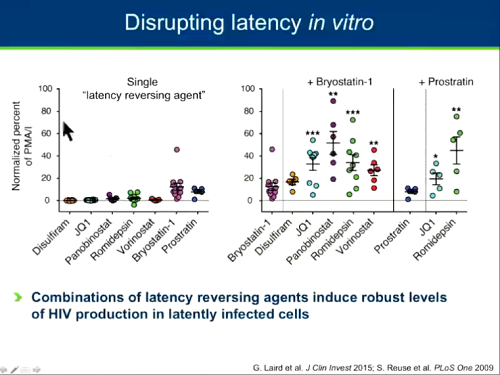
Ci sono farmaci che in vitro lavorano bene nel riattivare il virus dalla latenza e si è visto che i loro effetti possono essere combinati per ottenere un risultato maggiore della somma delle parti (sinergia).
Anche in vivo si sono visti dei segnali di riattivazione del virus latente grazie ad alcune delle sostanze che sono state sperimentate in piccoli trial pilota. Questo suggerisce che questi farmaci facciano quello che si suppone debbano fare.
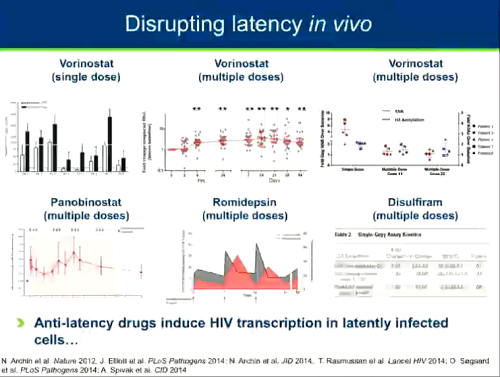
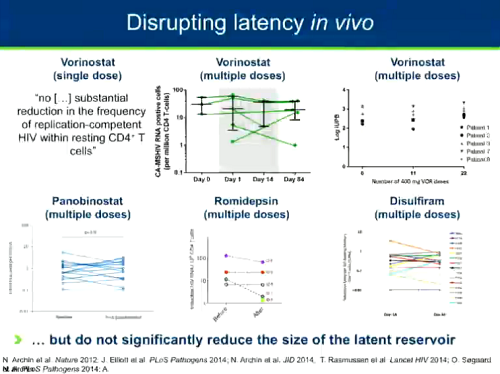
Il problema, però, è che anche se si è vista una certa riattivazione del virus in nessuno di questi trial si è osservata una riduzione significativa delle dimensioni del reservoir. Questo suggerisce che anche se si riattiva l'HIV questo non è sufficiente a portare all'eliminazione del reservoir. Questo ha portato gli scienziati a comprendere che si deve stimolare la funzione di "kill" della strategia shock and kill.
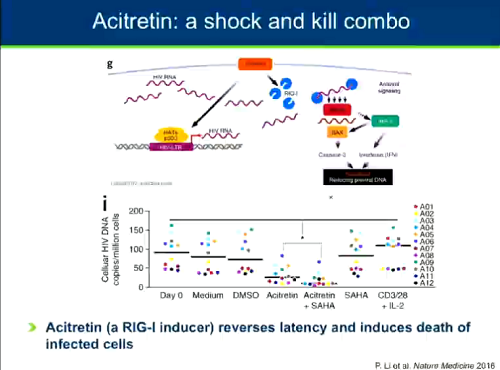
Ci sono nuove molecole, che sfruttano meccanismi diversi della latenza - una di queste è l'acitretin, di cui si parla in una presentazione al congresso. Ha una caratteristica che la rende molto appetibile, perché è capace al tempo stesso di invertire la latenza e indurre la morte delle cellule infette. Chomont la definisce una pallottola magica. Vedremo poi nei dettagli il lavoro in vitro portato al CROI.
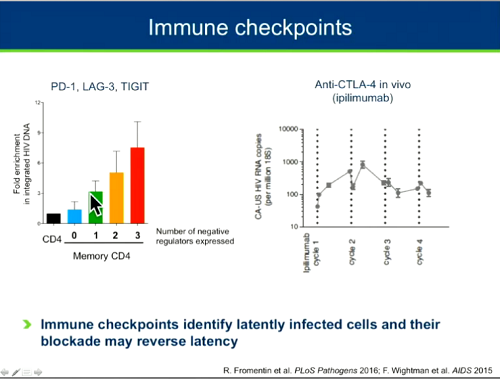
Un'altra strategia perseguita per combinare lo "shock" e il "kill" è quella degli inibitori dei checkpoint immunitari: questi caratterizzano le cellule latentemente infette (più alti sono i livelli di queste sostanze presenti nelle cellule, più è probabile che le cellule contengano HIV latente) quindi, se vengono bloccati, possono causare un'inversione della latenza (cfr. il thread Anticancro che blocca PD-1 e PD-L1 rinforza sistema immune).
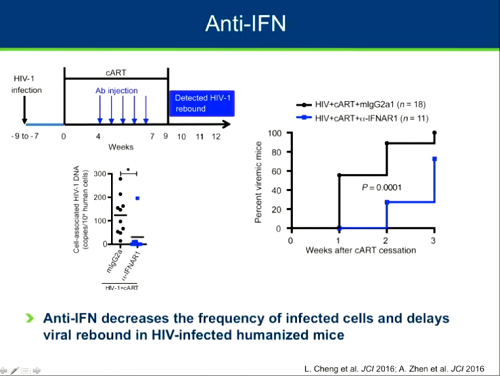
Altre strategie immunitarie sono quelle che prevedono la somministrazione di anticorpi anti-interferone I per diminuire la frequenza delle cellule infette e così ritardare il rebound della viremia quando si sospende la ART. Per ora questa via è stata sperimentata sui topi e si è visto che ha portato a una diminuzione consistente delle dimensioni del reservoir e soprattutto a un ritardo del rebound.
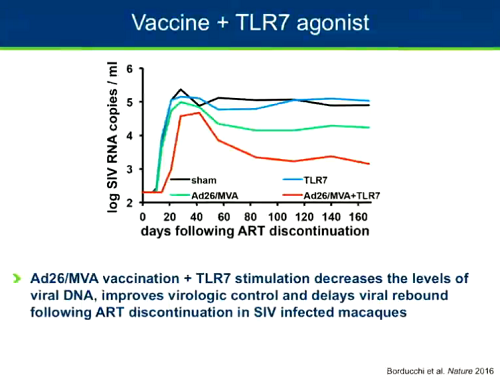
Un'altra strategia che è ancora contemporaneamente di shock e di kill e che Chomont definisce molto promettente è quella che vede la somministrazione congiunta di un vaccino terapeutico e di un agonista del TLR-7. In uno studio su scimmie, questa combinazione ha portato a una diminuzione dei livelli di DNA virale, a un miglioramento del controllo della viremia e a un ritardo del rebound quando la ART è stata interrotta (cfr. il thread Vaccino terapeutico Ad26/MVA + stimolazione TLR-7 (GS-986)).
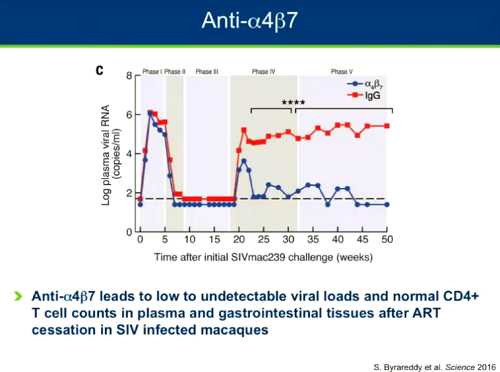
C'è poi l'uso di un anticorpo anti-α4β7, che ha permesso di mantenere viremie irrilevabili in un gruppo di scimmie. Questo suggerisce che se si riesce a impedire la migrazione delle cellule infette nell'intestino si può avere un impatto sul reservoir (cfr. il post L'ANTICORPO MONOCLONALE α4β7 INSIEME A UN BREVE CICLO DI ART INDUCE REMISSIONE VIROLOGICA SOSTENUTA IN UN GRUPPO DI SCIMMIE).
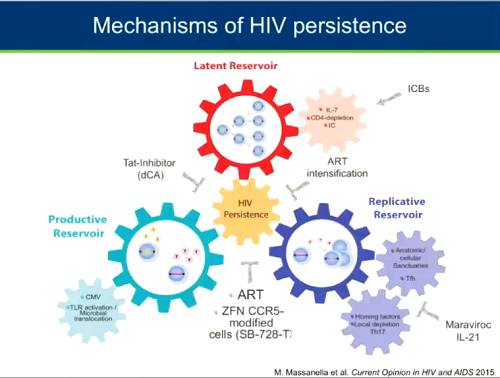
In conclusione: la domanda su come avvenga la persistenza di HIV è complessa e può ricevere molte e diverse risposte. Ma in sostanza i meccanismi che contribuiscono alla persistenza del virus sono tre: un reservoir latente, forse un reservoir replicativo in cui avviene replicazione, e un reservoir produttivo ancora piuttosto misterioso perché lo si vede raramente in azione, in cui la replicazione virale è attiva, ma forse le particelle virali prodotte non sono capaci di replicarsi.
Ciascuno di questi meccanismi è innescato da altri meccanismi: il reservoir latente è innescato dalla proliferazione omeostatica e forse anche dai checkpoint immunitari; il reservoir produttivo può essere attivato dall'attivazione del citomegalovirus e dalla attivazione immune causata dalla traslocazione microbica; il reservoir replicativo, infine, può essere innescato dalla mancanza o dalla deplezione dei linfociti Th17.
La bella notizia è che abbiamo delle armi per combattere contro questi meccanismi. La domanda è se dobbiamo (o possiamo) usare queste armi tutte insieme.